
Wetenschap
Onderzoekers verrijken zilverchemie
Illustratie. Zilver. Krediet:@tsarcyanide/MIPT
Onderzoekers van het Moscow Institute of Physics and Technology hebben samengewerkt met collega's in Rusland en Saoedi-Arabië en hebben een efficiënte methode voorgesteld voor het verkrijgen van fundamentele gegevens die nodig zijn voor het begrijpen van chemische en fysische processen waarbij stoffen in de gasvormige toestand betrokken zijn. Het voorgestelde numerieke protocol voorspelt het thermische effect van gasfasevorming van zilververbindingen en hun absolute entropie. Dit omvat de allereerste dergelijke gegevens voor meer dan 90 verbindingen. Gepubliceerd in het tijdschrift Anorganische scheikunde , de bevindingen zijn belangrijk voor praktische toepassingen van stoffen die zilver bevatten, ook in water- en wonddesinfectie, fotografie en cloud seeding.
Het team heeft de precieze waarden afgeleid van de vormingsenthalpie en de entropie van talrijke zilververbindingen. De enthalpie (van het Griekse "thalpein, " wat "verwarmen" betekent) van een systeem beschrijft zijn toestand in termen van de energie van de samenstellende deeltjes, druk en volume. Volgens de wet van Hess, het vermenigvuldigen van stoichiometrische coëfficiënten en het verschil tussen de vormingsenthalpieën van de reactanten en die van de producten levert de hoeveelheid warmte op die wordt gegenereerd of verbruikt in een chemische reactie. Entropie is een maat voor hoe ongeordend een systeem is. De tweede wet van de thermodynamica stelt dat een systeem spontaan een minder georganiseerde staat kan aannemen, dus entropie neemt toe met de tijd.
Het kennen van de waarden van enthalpie en entropie is cruciaal om te voorspellen of een reactie ooit zal plaatsvinden onder bepaalde omstandigheden. Deze kenmerken geven ook aan hoe reactieopbrengst en selectiviteit - de verhouding tussen producten - variëren met temperatuur en druk, optimalisatie mogelijk maken. De bevindingen stellen onderzoekers in staat om voorspellingen te doen over chemische processen die plaatsvinden in de gasfase. De gegevens zullen ook helpen bij het beheren van de processen die betrokken zijn bij dunne film en zuivere monsterafzetting uit de gasfase.
Er zijn in principe twee manieren om enthalpie- en entropieveranderingen te bepalen - ofwel door middel van complexe en kostbare experimenten, of door de gegevens uit naslagwerken te gebruiken en wat rekenwerk te doen op basis van de wet van Hess.
"De keuze lijkt voor de hand te liggen, vooral gezien het feit dat je de hitte van sommige reacties niet experimenteel kunt meten, " zei Joeri Minenkov, senior onderzoeker bij het Laboratorium voor Supercomputing Methoden in de fysica van de gecondenseerde materie. "Bijvoorbeeld, onvolledige grafietverbranding levert altijd zowel koolmonoxide als kooldioxide op. Dus zelfs door het thermische effect van de reactie te meten, we konden de enthalpie van koolmonoxidevorming niet bepalen.
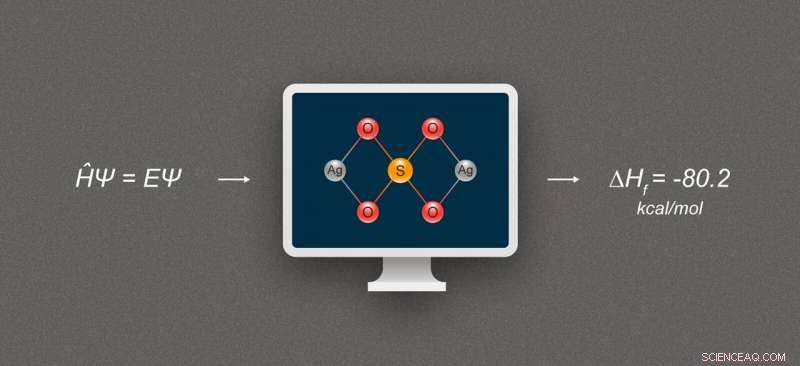
Figuur 1. Vereenvoudigd diagram dat de berekening van de vormingsenthalpie voor zilververbindingen illustreert. De afgebeelde verbinding is zilversulfaat, Ag₂SO₄. Krediet:@tsarcyanide/MIPT
"Maar de computationele benadering stuit op enkele problemen, ' ging Minenkov verder. 'Eerst, de vormingsenthalpieën en entropieën zijn niet voor elke verbinding bekend. Tweede, zelfs als de gegevens beschikbaar zijn, niemand kan hun nauwkeurigheid garanderen. De waarden variëren sterk tussen naslagwerken. Soms, de meetfouten kunnen behoorlijk groot zijn."
Gelukkig, kwantumchemie helpt bij het verkrijgen van de entropie en, tot op zekere hoogte, de enthalpiegegevens. Elk samenstellend molecuul van een gasvormige stof kan worden gezien als een systeem van positief geladen kernen en negatief geladen elektronen. Onderzoekers kunnen vervolgens elektronische structuurberekeningsmethoden toepassen om de moleculaire Schrödinger-vergelijking op te lossen. Dit onthult de totale elektronische energie van het molecuul, zijn golffunctie, en de ruimtelijke configuratie van kernen, dat wil zeggen, zijn 3D geometrische structuur. Natuurkundigen kunnen dan de entropie en enthalpie berekenen van een ideaal gas dat uit dergelijke moleculen bestaat. De op deze manier verkregen entropiewaarden worden vervolgens geïntroduceerd in naslagwerken en gebruikt in thermodynamische berekeningen.
Het probleem met enthalpie is dat, op dit moment geen fundamentele waarde is, het hangt sterk af van de gekozen methode voor de berekening van de Schrödingervergelijking.
Vernevelingsreacties worden gewoonlijk gebruikt om de vormingsenthalpie te berekenen. Bij zulke reacties de verbinding van belang valt uiteen in individuele atomen. Bijvoorbeeld, zilversulfide-Ag 2 S levert één zwavel- en twee zilveratomen op. Aangezien de vormingsenthalpieën van atomaire stoffen algemeen bekend zijn en in naslagwerken worden vermeld, het is mogelijk om de vormingsenthalpie van de oorspronkelijke stof te berekenen - in dit geval zilversulfide - door de enthalpieverandering in de reactie te vinden via kwantumchemische methoden.
Echter, wanneer moleculen die uit veel atomen bestaan, vernevelen, dit beïnvloedt de elektronische structuur zodanig dat enthalpie, te, wordt aanzienlijk veranderd. De momenteel beschikbare methoden van theoretische chemie kunnen deze effecten niet nauwkeurig genoeg verklaren.
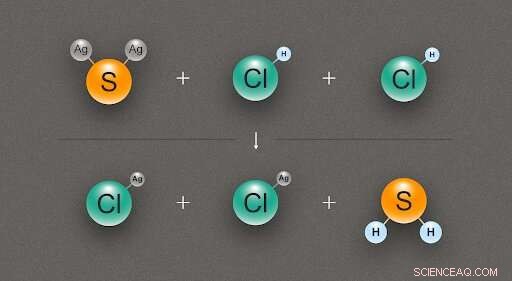
Figuur 2. Een diagram dat de chemische reactie illustreert tussen één zilversulfide (Ag₂S) en twee zoutzuur (HCl) moleculen, het produceren van twee moleculen zilverchloride (AgCl) en één van waterstofsulfide (H₂S). Krediet:@tsarcyanide/MIPT
Het team van onderzoekers van MIPT, het Frumkin Instituut voor Fysische Chemie en Elektrochemie van de Russische Academie van Wetenschappen, Ivanovo Staatsuniversiteit voor Scheikunde en Technologie, en de King Abdullah University of Science and Technology van Saudi-Arabië heeft een reeks artikelen gepubliceerd waarin een manier wordt voorgesteld om de thermodynamische eigenschappen van organische en anorganische verbindingen nauwkeuriger te berekenen.
In het geval van zilversulfide, de onderzoekers vonden de vormingsenthalpie van de reactie met zoutzuur, wat zilverchloride en waterstofsulfide oplevert (fig. 2). Aangezien het aantal obligaties in de bovenste rij hetzelfde is als in de onderste rij, de verandering in energie kan worden berekend met de minste fout.
De vormingswarmte voor zilverchloride, waterstofsulfide, en zoutzuur zijn met hoge nauwkeurigheid bekend, en computermodellering onthult het thermische effect van de reactie. Uit deze gegevens, het is mogelijk om de vormingswarmte van zilversulfide af te leiden met behulp van de wet van Hess.
"De klassieke gekoppelde-clusterbenadering, bekend als CCSD(T), is de gouden standaard voor het oplossen van de elektronische Schrödingervergelijking in de moderne kwantumchemie, " legde Minenkov uit. "We hebben het vervangen door de lokale versie genaamd DLPNO-CCSD(T), die niet lang geleden werd ontwikkeld door het Max Planck Instituut. Dit kromp de benodigde rekenkracht met een orde van grootte. Onder de conventionele CCSD(T), de rekentijd varieert met de grootte N van het molecuul als N 7 , dus voor grote moleculen is het geen optie. De lokale versie kost veel minder tijd en middelen."
Het team begon door te controleren hoe goed de resultaten van hun kwantumchemische berekeningen overeenkwamen met de experimentele thermodynamische en structurele gegevens. Naslagwerken vermeldden de waarden voor 10 zilververbindingen, en ze waren een goede match. Na er dus voor te hebben gezorgd dat hun model adequaat is, de onderzoekers berekenden de thermodynamische eigenschappen voor 90 ontbrekende zilververbindingen in de boeken. De gegevens zijn nuttig voor zowel wetenschappers die werkzaam zijn op het gebied van zilverchemie als voor het testen en kalibreren van nieuwe methoden voor elektronische structuurberekening.
 Drugsspons kan bijwerkingen van kankerbehandeling minimaliseren
Drugsspons kan bijwerkingen van kankerbehandeling minimaliseren Scholen moleculaire vissen kunnen beeldschermen verbeteren
Scholen moleculaire vissen kunnen beeldschermen verbeteren Pandemie biedt unieke kans voor atmosferische chemici
Pandemie biedt unieke kans voor atmosferische chemici Baanbrekende analyse laat zien hoe verschillende medicijnen een interactie aangaan met hetzelfde doelwit
Baanbrekende analyse laat zien hoe verschillende medicijnen een interactie aangaan met hetzelfde doelwit Chemisch ingenieur ontwikkelt styreenvrije bio-hernieuwbare harsen
Chemisch ingenieur ontwikkelt styreenvrije bio-hernieuwbare harsen
 Menselijk afval een aanwinst voor de economie, omgeving, studie vondsten
Menselijk afval een aanwinst voor de economie, omgeving, studie vondsten Microben in de bodem zijn essentieel voor het leven en kunnen de klimaatverandering helpen verminderen
Microben in de bodem zijn essentieel voor het leven en kunnen de klimaatverandering helpen verminderen De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen
De huidige toezeggingen om steenkoolstroom uit te faseren zijn kritisch onvoldoende om de klimaatverandering te vertragen Plastic rommel veroorzaakt ramp op onbewoond eiland in de Stille Oceaan
Plastic rommel veroorzaakt ramp op onbewoond eiland in de Stille Oceaan Cryptische koraalrifwezens vertonen diversiteitspatronen op de plank
Cryptische koraalrifwezens vertonen diversiteitspatronen op de plank
Hoofdlijnen
- Intron: definitie, functie en belang bij RNA-splitsing
- Elk levend wezen maakt deel uit van een ecosysteem. Hier is hoe ze werken
- DNA-klonen: definitie, proces, voorbeelden
- Wetenschappers werken aan een periodiek systeem voor ecologie
- Staan we allemaal af van een gemeenschappelijke vrouwelijke voorouder?
- De voordelen van Anaerobe Ademhaling
- Handelen of niet handelen? De ivoren impasse doorbreken
- De voordelen en nadelen van het Bacillus-expressiesysteem
- Waarom zie je nooit vierkante groenten?
- Grafeenmembranen kunnen nucleaire industrie groener maken

- Knipperend licht verandert bacteriën in chemische fabrieken

- Chemici leren hoe ze fenolen in gerookte voedselmonsters kunnen detecteren met behulp van vitamine B4

- Uitvinding van 's werelds sterkste zilver

- Mechanische ademhaling in slimme ramen

 Polymeerfilms slagen voor de elektronenkanontest
Polymeerfilms slagen voor de elektronenkanontest Nieuwe gegevens over bodemvocht en temperatuur helpen levensbedreigende Indiase moessonregens te voorspellen
Nieuwe gegevens over bodemvocht en temperatuur helpen levensbedreigende Indiase moessonregens te voorspellen Een effectieve strategie voor het beschermen van skyrmionen in kwantumcomputers
Een effectieve strategie voor het beschermen van skyrmionen in kwantumcomputers Voormalige rebellengroepen worden gematigder na het verkrijgen van politieke macht in landen met democratie, uit onderzoek blijkt
Voormalige rebellengroepen worden gematigder na het verkrijgen van politieke macht in landen met democratie, uit onderzoek blijkt Steden als studieproxy's voor klimaatverandering
Steden als studieproxy's voor klimaatverandering NASA test atoomklok voor navigatie in de diepe ruimte
NASA test atoomklok voor navigatie in de diepe ruimte Kan machine learning sneller en goedkoper kritische marktinzichten opleveren over de behoeften van de consument?
Kan machine learning sneller en goedkoper kritische marktinzichten opleveren over de behoeften van de consument? Nieuwe kwantumlus biedt testbed voor kwantumcommunicatietechnologie
Nieuwe kwantumlus biedt testbed voor kwantumcommunicatietechnologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

