Wetenschap
Neutronen schilderen atomair portret van prototypisch celsignaleringsenzym
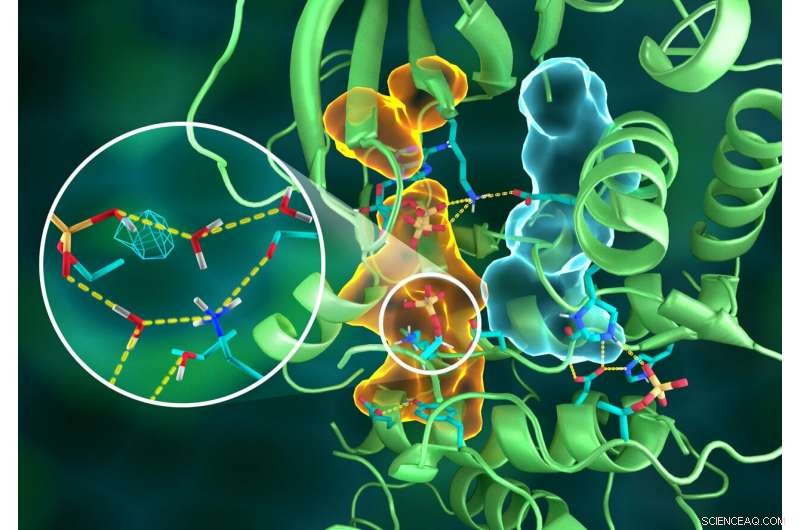
Illustratie van de ingewikkelde organisatie van de PKA-structuur, waarbij verschillende delen van het eiwit zijn verbonden via uitgebreide waterstofbindingsnetwerken (gestreepte gele lijnen), aan elkaar gelijmd door de hydrofobe assemblages (lichtblauwe en oranje volumes) -- die allemaal samenwerken om de functionele actieve site te bouwen. Insert toont protonering van de overgedragen fosforylgroep (cyaan mesh) en de vele interacties met water en de aminozuurresiduen op de actieve plaats. Krediet:ORNL/Jill Hemman
Directe observaties van de structuur en het katalytische mechanisme van een prototypisch kinase-enzym - eiwitkinase A of PKA - zullen onderzoekers en medicijnontwikkelaars aanzienlijk betere mogelijkheden bieden om dodelijke ziekten en neurologische aandoeningen zoals kanker te begrijpen en te behandelen, suikerziekte, en cystische fibrose.
De ontdekking werd gedaan door een internationaal team van onderzoekers met behulp van macromoleculaire neutronenkristallografie bij het Oak Ridge National Laboratory van het Department of Energy en het Institut Laue-Langevin in Grenoble, Frankrijk. Voortbouwend op een tien jaar durend onderzoek, de gecombineerde inspanningen onthulden voorheen onbekende kenmerken van het archetypische eiwitkinase, inclusief een volledige kaart van de atomaire structuur en de onderbouwing van de chemie van het enzym dat wordt gebruikt bij cellulaire signalering. De details worden gepubliceerd in het tijdschrift wetenschappelijke vooruitgang .
Kinasen zijn een grote groep van honderden enzymen die verantwoordelijk zijn voor het initiëren en reguleren van talloze cellulaire processen. Kinasen sturen signalen naar eiwitten door middel van fosforylering - het toevoegen van een reactieve chemische groep bestaande uit fosfor en zuurstof aan een specifieke locatie op een substraateiwit om zijn specifieke biologische functie te activeren.
Er ontstaan problemen wanneer genmutaties ervoor zorgen dat kinasen niet goed werken, wat weer leidt tot ziekte. Een slecht functionerende kinase, of een die niet kan worden gedeactiveerd, zou verantwoordelijk kunnen zijn voor de overexpressie van eiwitten die leiden tot de oncontroleerbare verspreiding van kankercellen. Het tegenovergestelde is ook het geval bij neurologische aandoeningen waarbij een slecht functionerend kinase ervoor zorgt dat cellen doodgaan.
"Het maken van medicijnen die gericht zijn op specifieke kinasen is uiterst belangrijk, "Zei co-auteur Andrey Kovalevsky. "Dit gedetailleerde begrip van de PKA-structuur en zijn dynamiek zal ons meer vertellen over andere soorten kinasen en zou medicijnontwikkelaars moeten helpen bij het ontwerpen van nieuwe medicijnen met een betere specificiteit, wat zich uiteindelijk zou vertalen in preciezere therapieën met minder bijwerkingen."
Veranderingen in de eiwitstructuur als gevolg van mutaties kunnen moeilijk te detecteren zijn, hoewel de effecten van mutaties op het dynamische gedrag van het eiwit behoorlijk diepgaand kunnen zijn. Echter, deze dynamische gedragingen worden duidelijker door het algehele waterstofbindingsnetwerk door het eiwit te onderzoeken.
Neutronen zijn uniek gevoelig voor lichte elementen zoals waterstof. Omdat ongeveer 50 procent van alle atomen in eiwitten waterstof zijn, en de meeste chemische reacties die enzymen katalyseren, hebben betrekking op waterstof, neutronen zijn een ideale en onovertroffen sonde voor het detecteren van de posities van waterstofatomen in de eiwitstructuur en het volgen van hun beweging tijdens katalyse.
Neutronendiffractie met behulp van de IMAGINE-diffractometer bij ORNL's High Flux Isotope Reactor, een DOE Office of Science gebruikersfaciliteit, en de LADI-III-diffractometer bij ILL stelde onderzoekers in staat om de exacte posities van waterstofatomen te zien om de volledige kinasestructuur te onthullen, evenals de protoneringstoestanden van alle aminozuren in PKA en de liganden gebonden aan de actieve plaats, waarvan vele voorheen onbekend waren.
"Met neutronen konden we röntgenvoorspellingen van waterstofatoomposities valideren, evenals het bepalen van de protoneringstoestanden van chemische groepen die niet bekend waren, of op plaatsen waar we ze niet verwachtten te vinden. Deze belangrijke chemische vooruitgang maakt de weg vrij voor meer geavanceerde moleculaire modellering en simulatiestudies van de structuur en functie van proteïnekinase, " zei corresponderende auteur Susan Taylor.
"Neutronen bieden een ongekend beeld van het waterstofbrugnetwerk rondom en binnen de actieve site van PKA en geven cruciale inzichten over hoe allosterische overdracht van informatie door de eiwitstructuur plaatsvindt, " voegde co-auteur Gianluigi Veglia toe. "De combinatie van neutronenkristallografie met nucleaire magnetische resonantiespectroscopie zal een uitgebreid begrip opleveren van hoe enzymen werken."
 IJstijdtesten onthullen uitdagingen in de gevoeligheid van klimaatmodellen
IJstijdtesten onthullen uitdagingen in de gevoeligheid van klimaatmodellen Een tijdcapsule met 118 biljoen kubieke voet gas is begraven in het noorden van Australië
Een tijdcapsule met 118 biljoen kubieke voet gas is begraven in het noorden van Australië Walvis sterft in Thailand na inslikken van 80 plastic zakken
Walvis sterft in Thailand na inslikken van 80 plastic zakken Conflict en klimaatverandering leiden tot een toename van honger wereldwijd
Conflict en klimaatverandering leiden tot een toename van honger wereldwijd Gifstoffen in water onder elektriciteitscentrale Tennessee veroorzaken alarm
Gifstoffen in water onder elektriciteitscentrale Tennessee veroorzaken alarm
Hoofdlijnen
- "3-D Printing Goes Cellular
- Nieuwe transdisciplinaire studie onthult microben die op een dag een grote druivenziekte kunnen afschrikken
- Projectideeën om het menselijk spijsverteringssysteem op de middelbare school voor studenten te laten zien
- 10 oudst bekende ziekten
- Hoe een zevende-graadsmodel van een dierencel te bouwen
- Nieuw apparaat zoomt in op microbengedrag op de juiste schaal
- De functies van de linker temporale kwab
- Doen eukaryote cellen door binaire fissie?
- Science Fair-projecten met nagellak
 Bereidheid om risico's te nemen - een persoonlijkheidskenmerk
Bereidheid om risico's te nemen - een persoonlijkheidskenmerk De pandemie van het coronavirus kan gebouwen ziek maken, te
De pandemie van het coronavirus kan gebouwen ziek maken, te Nieuw model van polarisatie werpt licht op de politiek van vandaag
Nieuw model van polarisatie werpt licht op de politiek van vandaag Machine luistert naar aardbevingen:algoritmen halen verborgen signalen uit die de productie van geothermische energie kunnen stimuleren
Machine luistert naar aardbevingen:algoritmen halen verborgen signalen uit die de productie van geothermische energie kunnen stimuleren Argonnes baanbrekende gebruikersfaciliteit om magische nummerfabriek toe te voegen
Argonnes baanbrekende gebruikersfaciliteit om magische nummerfabriek toe te voegen Het effect van temperatuur op bellenoplossing
Het effect van temperatuur op bellenoplossing  Nauwkeurigere stikstofaanbevelingen voor maïs om boeren te helpen, vervuiling verminderen
Nauwkeurigere stikstofaanbevelingen voor maïs om boeren te helpen, vervuiling verminderen Onderzoekers ontwikkelen een krachtige, draagbare terahertz-laser
Onderzoekers ontwikkelen een krachtige, draagbare terahertz-laser
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com