Wetenschap
Wetenschappers ontdekken fijne kneepjes van serotoninereceptor die cruciaal zijn voor betere therapieën
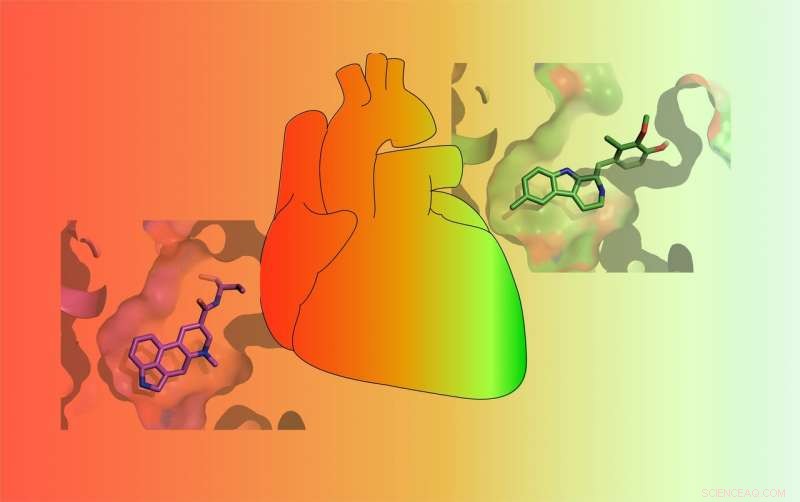
Geneesmiddelen variëren in hun vermogen om de 5-HT2B-serotoninereceptor te activeren. Sommige geneesmiddelen (RED) activeren de receptor sterk en veroorzaken mogelijk levensbedreigende hartklepaandoeningen, terwijl andere deze slechts zwak activeren (GROEN) en hebben minder kans op ernstige bijwerkingen. Krediet:Roth Lab
serotonine, bekend als de "geluks" neurotransmitter, is een chemische stof die in het lichaam wordt aangetroffen en verantwoordelijk is voor gevoelens van welzijn. Maar serotonine is niet de enige chemische stof die zich bindt aan de 13 serotoninereceptoren die op het oppervlak van cellen worden aangetroffen. Verre van. Veel goedgekeurde geneesmiddelen binden zich ook aan serotoninereceptoren. En een van deze receptoren, 5-HT2BR genaamd, heeft medicijnontwikkelaars erg ongelukkig gemaakt. Dat komt omdat sommige medicijnen die de ziekte van Parkinson behandelen, migraine, hypofyse tumoren, en obesitas werden ontworpen om andere cellulaire receptoren te targeten, maar ook om 5-HT2BR te activeren, leidend tot levensbedreigende hartklepaandoeningen. Als resultaat, veel van deze medicijnen zijn van de markt gehaald.
Nutsvoorzieningen, Voor de eerste keer, Wetenschappers van de UNC School of Medicine hebben precies ontdekt waarom één medicijn zich bindt aan 5-HT2BR en de receptor activeert om hartproblemen te veroorzaken, terwijl vergelijkbare medicijnen dat niet doen. Ze hebben ook ontdekt waarom een derde medicijn werkt als een 5-HT2BR-antagonist - het blokkeert de activiteit van de receptor - terwijl het zeer bekende vergelijkbare hallucinogene medicijn LSD dat niet doet.
Gepubliceerd in Natuur Structurele en moleculaire biologie , dit onderzoek biedt medicijnontwikkelaars het broodnodige inzicht in deze serotoninereceptor en andere soortgelijke.
"Voor een lange tijd, we moesten precies weten hoe deze receptor en andere aan verschillende verbindingen binden als we veiligere en effectievere medicijnen willen ontwerpen, " zei senior auteur Bryan L. Roth, MD, doctoraat, de Michael Hooker Distinguished Professor of Protein Therapeutics and Translational Proteomics in de afdeling Farmacologie. "Het oplossen van de kristalstructuren van deze serotoninereceptoren die aan verschillende verbindingen zijn gebonden, is de essentiële eerste stap die nodig is om betere medicijnen te maken, niet alleen voor de bovengenoemde aandoeningen, maar voor vele andere, waaronder schizofrenie, ongerustheid, en depressie."
In experimenten onder leiding van John McCorvy, doctoraat, die tijdens dit onderzoek postdoctoraal was in het Roth-lab, wetenschappers zorgden er nauwgezet voor dat de receptoren condenseerden tot een dicht opeengepakt kristalrooster terwijl de receptoren aan een medicijn waren vastgemaakt. Vervolgens schoten ze röntgenstralen op het kristal om de structuur van de receptor te berekenen uit de resulterende diffractiepatronen. McCorvy en collega's deden dit verschillende keren om serotoninereceptoren te kristalliseren die aan verschillende verbindingen zijn gebonden, wat decennialang onmogelijk was geweest omdat receptoren notoir wispelturige eiwitten zijn - kleine, breekbaar, en meestal in beweging als ze aan verbindingen binden.
De wetenschappers gebruikten vervolgens andere experimentele technieken die in het artikel worden beschreven om precies te laten zien hoe elk medicijn de receptor activeerde of niet activeerde.
In een reeks experimenten, McCorvy en collega's toonden aan dat methylergonovine - het actieve ingrediënt in een migrainemedicijn - zich bindt aan een bepaald gebied van 5-HT2BR en het activeert. Methylergonovine is een agonist. Maar de moederverbinding, methysergide, activeert de receptor niet, waardoor het een antagonist wordt. Roth's lab ontdekte dat het verschil tussen de twee medicijnen slechts één koolstofatoom en een paar waterstofatomen is. Samen worden ze een methyl genoemd. Deze kleine methyl blijkt de boosdoener te zijn bij hartklepproblemen die verband houden met 5-HT2BR.
In een tweede reeks experimenten, ze toonden aan waarom het Parkinson-medicijn lisuride 5-HT2BR niet activeert, maar LSD wel. Het verschil op de bindingsplaats is slechts een enkel stikstofatoom en stereochemie - in wezen de ruimte tussen het medicijn en de receptor die een rol speelt in hoe precies een medicijn in de receptor zou kunnen passen om cellulaire activiteit te activeren of te stoppen.
interessant, lisuride en LSD binden aan de serotoninereceptor in de typische regio die wetenschappers zouden verwachten. Maar de chemie van hoe die twee medicijnen op die plaats binden, verklaart niet hun zeer verschillende effecten op cellen en mensen. McCorvy en collega's ontdekten dat lisuride ook vastzit in een ander deel van de receptor, de verlengde bindingszak genaamd, maar het contact van lisuride is niet sterk. LSD daarentegen bindt sterk aan de verlengde bindingszak, waardoor LSD een zeer sterke agonist wordt - het activeert 5-HT2BR (evenals andere receptoren). LSD doet dit door een eiwit te rekruteren dat bèta-arrestin2 wordt genoemd. Wetenschappers noemen dit proces "het activeren van de β-arrestin-route, " en het is betrokken bij verschillende bijwerkingen die verband houden met therapieën.
Deze bevindingen zullen medicijnontwerpers helpen om 5-HT2BR te vermijden bij het ontwerpen van medicijnen die zich richten op andere receptoreiwitten - gewoonlijk aangeduid als G-eiwit-gekoppelde receptoren, of GPCR's. Omgekeerd, dit onderzoek zal medicijnontwikkelaars helpen die de activering van 5-HT2BR willen remmen om hartklepaandoeningen en andere aandoeningen te behandelen.
"In principe, door de structuren van 5-HT2BR gebonden aan verschillende veel voorkomende medicijnen te kristalliseren, we ontdekten dat er geen enkel mechanisme is waardoor de receptor wordt geactiveerd, "Zei McCorvy. "Er zijn er meerdere." Om een precieze, veilig, en effectieve medicatie, wetenschappers willen alleen de cellulaire paden benutten die belangrijk zijn voor de behandeling van de aandoening waarin ze geïnteresseerd zijn. McCorvy voegde toe, "Dat is de voorhoede van de ontwikkeling van geneesmiddelen."
 Forensische wetenschappers ontsluiten unieke chemische handtekeningen in banden
Forensische wetenschappers ontsluiten unieke chemische handtekeningen in banden Supersnel inzicht in mobiele gebeurtenissen
Supersnel inzicht in mobiele gebeurtenissen Studie onthult radicale rimpel bij vorming van complexe koolstofmoleculen in de ruimte
Studie onthult radicale rimpel bij vorming van complexe koolstofmoleculen in de ruimte Dunne films van een loodvrij piëzo-elektrisch komen eindelijk overeen met de prestaties van de looddragende standaard
Dunne films van een loodvrij piëzo-elektrisch komen eindelijk overeen met de prestaties van de looddragende standaard Biologie, behoefte aan snelheid, tolereert een paar fouten
Biologie, behoefte aan snelheid, tolereert een paar fouten
Hoofdlijnen
- Kunnen mensen eeuwig leven?
- Wat moet er gebeuren met de DNA-strengen in de kern voordat de cel kan delen?
- Overeenkomsten van mitose en meiose
- Schapen kunnen menselijke gezichten van foto's herkennen
- Genoomgrootte beïnvloedt of planten invasief worden
- Een DNA-model maken met behulp van pijpreinigers
- Ontdekt? Nieuw maar uitgestorven menselijk familielid uit Melanesië
- "3-D Printing Goes Cellular
- Wat is de basis voor uitzonderingen op het Aufbau-principe?
 Astrofysici simuleren microscopisch kleine clusters van de oerknal
Astrofysici simuleren microscopisch kleine clusters van de oerknal Wetenschappers bouwen transistor met één atoom
Wetenschappers bouwen transistor met één atoom Hoe ontoegankelijke plaatsen te verkennen door zwermen sensoren
Hoe ontoegankelijke plaatsen te verkennen door zwermen sensoren De spookbossen van de oostkust
De spookbossen van de oostkust Facebook:waren beter in het controleren van naaktheid dan in het aanzetten tot haat
Facebook:waren beter in het controleren van naaktheid dan in het aanzetten tot haat 5 Groene NASA-uitvindingen
5 Groene NASA-uitvindingen  Variabele winden op hete gigantische exoplaneet helpen bij het bestuderen van magnetisch veld
Variabele winden op hete gigantische exoplaneet helpen bij het bestuderen van magnetisch veld Onderzoek wijst de weg naar betrouwbaardere op koolstof gebaseerde micro-elektronica
Onderzoek wijst de weg naar betrouwbaardere op koolstof gebaseerde micro-elektronica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com