
Wetenschap
Eiwit dat volledig vanuit het niets is ontworpen, functioneert in cellen als een echt enzym
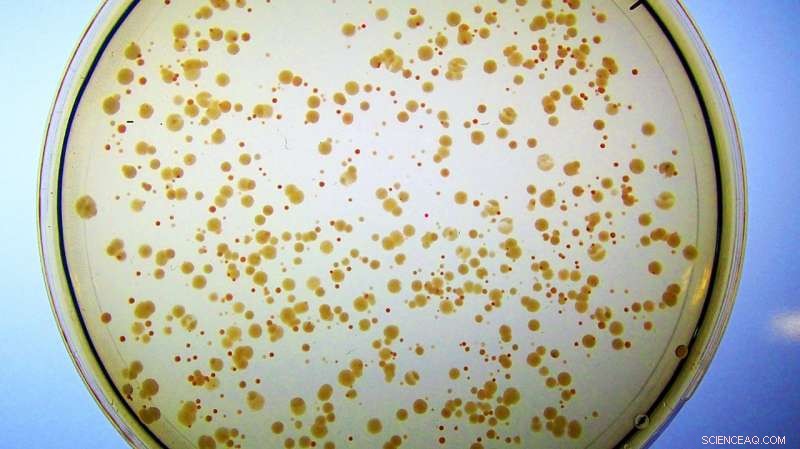
Kolonies van E. coli groeien op ijzerrijk medium. Alle cellen zijn ontworpen om hun natuurlijke Fes-enzym te verliezen. Ze vormen kleine, ongezonde rode kolonies omdat ze ijzer ophopen dat gebonden is aan enterobactine, en nauwelijks genoeg vrij ijzer hebben om te groeien. In tegenstelling tot, cellen met het kunstmatige enzym Syn-F4 vormen grote, gezonde witte kolonies omdat het nieuwe eiwit de splitsing van enterobactine en de daaropvolgende afgifte van het ijzer dat nodig is voor een gezonde groei katalyseert. (Opmerking:als deze cellen op petrischalen met minimaal ijzer werden geplaatst, de rode kolonies zouden helemaal niet verschijnen omdat ze niet genoeg vrij ijzer zouden hebben om de celgroei te ondersteunen.) Credit:Ann Donnelly/Hecht Lab/Princeton University
Een ontluikend onderzoeksveld, kunstmatige biologie, werkt aan het creëren van een werkelijk nieuw organisme. bij Princeton, scheikundeprofessor Michael Hecht en de onderzoekers in zijn laboratorium ontwerpen en bouwen eiwitten die de chemische processen die het leven in stand houden, kunnen vouwen en nabootsen. Hun kunstmatige eiwitten, gecodeerd door synthetische genen, zijn ongeveer 100 aminozuren lang, met behulp van een eindeloos variërende rangschikking van 20 aminozuren.
Nutsvoorzieningen, Hecht en zijn collega's hebben bevestigd dat ten minste één van hun nieuwe eiwitten biologische reacties kan katalyseren, wat betekent dat een eiwit dat helemaal opnieuw is ontworpen, in cellen functioneert als een echt enzym.
Enzymen zijn de sleutel tot de hele biologie, zei Hecht. "Biologie is het systeem van biochemische reacties en katalysatoren. Elke stap heeft een enzym dat het katalyseert, omdat die reacties anders niet snel genoeg zouden gaan om leven te laten bestaan. ... Een enzym is een eiwit dat een katalysator is. Ze zijn de beste katalysatoren in het universum, omdat de evolutie er miljarden jaren over heeft gedaan om ze te selecteren. Enzymen kunnen de snelheid van een reactie met vele ordes van grootte verhogen."
Nadat Hecht en zijn onderzoeksteam met succes kunstmatige eiwitten voor E. coli hadden gemaakt, ze gingen op zoek naar kritieke functies die ze konden verstoren in deze eenvoudige bacteriën. Ze vonden vier genen die, wanneer verwijderd, zouden niet alleen de E. coli inert maken - effectief dood - maar die hun kunstmatige eiwitten vervolgens zouden kunnen "redden, "of reanimeren.
Ze identificeerden deze kunstmatige eiwitten voor het eerst in 2011, en ze hebben de afgelopen zes jaar gewerkt aan het achterhalen van de precieze mechanismen waarmee hun nieuwe eiwitten functioneerden, nu gedetailleerd in een paper van 15 januari in Natuur Chemische Biologie .
Het is belangrijk om niet aan te nemen dat een kunstmatig eiwit op dezelfde manier zal werken als het natuurlijke eiwit waarvan het de verwijdering redt, Hecht waarschuwde.
Om de mechanismen te bepalen die hun kunstmatige eiwitten gebruikten, waren talloze experimenten nodig. "We hadden vier verschillende gendeleties - vier verschillende enzymatische functies, " zei Ann Donnelly, hoofdauteur op het papier.
Na jaren van experimenteren, het team had geconcludeerd dat twee van deze "reddingen" werken door enzymen te vervangen - eiwitten die dienen om andere reacties te katalyseren, hen te helpen snel genoeg te werken om het leven in stand te houden - met eiwitten die zelf geen enzymen waren, maar die de productie van andere processen in de cel stimuleren, ze zei. De derde toonde vooruitgang, maar de vierde had meerdere onderzoekers gefrustreerd die door het lab van Hecht kwamen.
Maar dan Donnelly, die een afgestudeerde student was toen ze het onderzoek deed en nu een onderzoeksspecialist in bio-informatica is aan de Universiteit van Pittsburgh, code gekraakt.
"Dit kunstmatige eiwit, Syn-F4, was eigenlijk een enzym, "Zei Donnelly. "Dat was een ongelooflijk en ongelooflijk moment voor mij - ongelooflijk tot op het punt dat ik niets wilde zeggen totdat ik het verschillende keren had herhaald."
Ze vertelde alleen Katie Digianantonio, een medestudent, en Grant Murphy, een postdoctoraal onderzoeker, die co-auteurs zijn van het nieuwe artikel. "Ik zei, 'Volgens mij is dit een enzym.' Ik liet ze de eerste gegevens zien en zei:'Zeg niets tegen Michael. Laat me dit nog een keer doen." Donnelly zuiverde het eiwit opnieuw, en creëerde een nieuwe, perfect zuiver substraat voor de E. coli. "Ik heb alles opnieuw gelopen vanuit verschillende voorbereidingen - en toen het resultaat stand hield, Ik vertelde Michael, " ze zei.
Van de originele set eiwitten die gendeleties konden redden, dit is de enige die een enzym bleek te zijn - althans tot nu toe, ze zei.
"We hebben een volledig nieuw eiwit dat in staat is om het leven in stand te houden door eigenlijk een enzym te zijn - en dat is gewoon gek, ' zei Hecht.
Dit heeft grote gevolgen voor de industrie, zei Justin Siegel, faculteitsdirecteur van het Innovation Institute for Food and Health en een assistent-professor scheikunde, biochemie en moleculaire geneeskunde aan het UC Davis Genome Center, die niet bij het onderzoek betrokken was.
"Biotechnologie gebruikt vaak enzymen om industriële processen uit te voeren voor de productie van materialen, voedsel, brandstof en medicijnen, Siegel zei. "Het gebruik van deze enzymen in een industriële omgeving begint vaak met een enzym dat de natuur miljarden jaren lang heeft ontwikkeld voor een niet-verwant doel, en vervolgens wordt het eiwit aangepast om zijn functie voor de moderne toepassing te verfijnen. Het rapport hier laat zien dat we niet langer beperkt zijn tot de door de natuur geproduceerde eiwitten, en dat we eiwitten kunnen ontwikkelen - die normaal gesproken miljarden jaren nodig zouden hebben om te evolueren - in een kwestie van maanden."
Hechts team had een stam van E. coli gemaakt die het enzym Fes miste, zonder welke het geen toegang heeft tot het ijzer dat nodig is om in leven te blijven. "We hebben allemaal ijzer nodig, "Zei Hecht. "Ook al is er veel ijzer op aarde, biologisch toegankelijk ijzer is dat niet." Cellen hebben moleculen ontwikkeld zoals enterobactine, hij legde uit, die ijzer uit elke beschikbare bron kan wegvangen, maar dan hebben ze een hulpmiddel nodig - zoals Fes - om het ijzer uit de stevige greep van de enterobactine te ontworstelen.
Deze gemodificeerde E. coli-stam had geen manier om te extraheren, of hydrolyseren, het ijzer uit zijn enterobactine, totdat het werd "gered" door Syn-F4. De onderzoekers hadden ijzer geleverd aan de E. coli, maar het kleurde alleen de cellen rood, want hoewel ze het gebonden metaal konden ophopen, ze konden het niet bevrijden van enterobactine of er toegang toe krijgen voor cellulair gebruik.
"En toen merkte Ann op... ze zijn niet meer rood, ze zijn wit, wat suggereert dat de cellen dit kunnen afbreken en het ijzer kunnen krijgen, wat suggereert dat we eigenlijk een enzym hebben!" zei Hecht.
"Miljoenen jaren van evolutie resulteerden in Fes, een perfect goed enzym voor het hydrolyseren van enterobactine, " zei Wayne Patrick, een universitair hoofddocent biochemie aan de Universiteit van Otago in Nieuw-Zeeland, die niet bij het onderzoek betrokken was. "Het is gemakkelijk genoeg om de structuur te bestuderen, functie en mechanisme van Fes, en om iets over zijn evolutie af te leiden door het te vergelijken met verwante sequenties. Maar het is veel moeilijker (en interessanter) om te vragen of Fes de oplossing is voor het biochemische probleem van het hydrolyseren van enterobactine - of dat het een van de vele oplossingen is. Donnelly et al. hebben aangetoond dat een enzym dat nooit is geboren (behalve kunstmatig, in hun lab) had niettemin een even goede oplossing kunnen zijn (als ze de kans had gekregen).
"Die redenering heeft verschillende implicaties, " legde Patrick uit. "Een daarvan is voor het leven dat nog op aarde ontdekt moet worden. Misschien ooit, we zullen een natuurlijk enzym vinden dat op Syn-F4 lijkt, maar de plaats van Fes in een of ander micro-organisme inneemt. Nu tenminste, we zullen weten te kijken. Een andere implicatie is voor astrobiologie. Als er veel even waarschijnlijke oplossingen zijn voor een biochemisch probleem, het wordt waarschijnlijker dat er elders in het universum een oplossing is gevonden."
Onderzoekers staan aan de vooravond van een echte synthetische biologie, zei Hecht.
"E. coli heeft 4, 000 verschillende genen, " zei hij. "We hebben niet alle 4 getest, 000, omdat dit experiment alleen werkt als er niets groeit op minimaal medium, en van de 4, 000, dat is alleen waar voor sommigen.
"We beginnen te coderen voor een kunstmatig genoom. We hebben 0,1 procent van het E. coli-genoom gered. ... Voor nu, het is een rare E. coli met enkele kunstmatige genen die het mogelijk maken om te groeien. Stel dat u 10 procent of 20 procent vervangt. Dan is het niet zomaar een rare E. coli met wat kunstmatige genen, dan moet je zeggen dat het een nieuw organisme is."
 Trump-begrotingsplan zou verbod op verkoop en slachting van wilde paarden opheffen
Trump-begrotingsplan zou verbod op verkoop en slachting van wilde paarden opheffen  De atmosfeer van de aarde is chemisch reactiever in koude klimaten
De atmosfeer van de aarde is chemisch reactiever in koude klimaten Een aardbeving met een kracht van 7,2 op de schaal van Richter treft Haïti; minstens 227 doden
Een aardbeving met een kracht van 7,2 op de schaal van Richter treft Haïti; minstens 227 doden NASA's Aqua-satelliet ziet de kleine, machtige Beryl
NASA's Aqua-satelliet ziet de kleine, machtige Beryl De ramp met de zee in Sri Lanka verergert naarmate de milieutol stijgt
De ramp met de zee in Sri Lanka verergert naarmate de milieutol stijgt
Hoofdlijnen
- Verschil tussen triglyceriden en fosfolipiden
- Wat zijn de functies van mRNA & tRNA?
- Retrovirus versus DNA-virus
- Hoe is zuurstof belangrijk voor de afgifte van energie in de celademhaling?
- Wat is een gen?
- Nieuwe transdisciplinaire studie onthult microben die op een dag een grote druivenziekte kunnen afschrikken
- Informatie over bloedvaten
- Wat zijn de functies van zetmeel in plantencellen?
- Dolfijnen- en berenstudies maken de weg vrij voor verbeterde populatieprognoses
- Neutronen onderzoeken biologische materialen voor inzicht in COVID-19-virusinfectie
- Chemische dans van kobaltkatalyse kan de weg vrijmaken voor zonnebrandstoffen

- Wetenschappers stellen voor om machine learning te gebruiken om materiaaleigenschappen te voorspellen

- Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties
- Onderzoekers ontdekken structuur van anti-verouderingshormoon
 Vroege verspreiding voor viervoetige walvisachtigen:amfibische walvis uit midden Eoceen
Vroege verspreiding voor viervoetige walvisachtigen:amfibische walvis uit midden Eoceen CES 2019:Family tech gadgets doen een beroep op ouderlijke angst
CES 2019:Family tech gadgets doen een beroep op ouderlijke angst China's app voor het delen van fietsen Ofo haalt $ 850 miljoen op om overzee uit te breiden
China's app voor het delen van fietsen Ofo haalt $ 850 miljoen op om overzee uit te breiden Het gebruik van producentengas
Het gebruik van producentengas  Wat is snelheid?
Wat is snelheid?  Nieuwe pulsduur bereikt door laserstraallijn
Nieuwe pulsduur bereikt door laserstraallijn Natuurkundigen stellen een tweede niveau van kwantisatie voor voor de kwantum Shannon-theorie
Natuurkundigen stellen een tweede niveau van kwantisatie voor voor de kwantum Shannon-theorie De Angelsaksen waren erger dan de Vikingen
De Angelsaksen waren erger dan de Vikingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

