
Wetenschap
Het bereik van therapeutische antilichamen vergroten
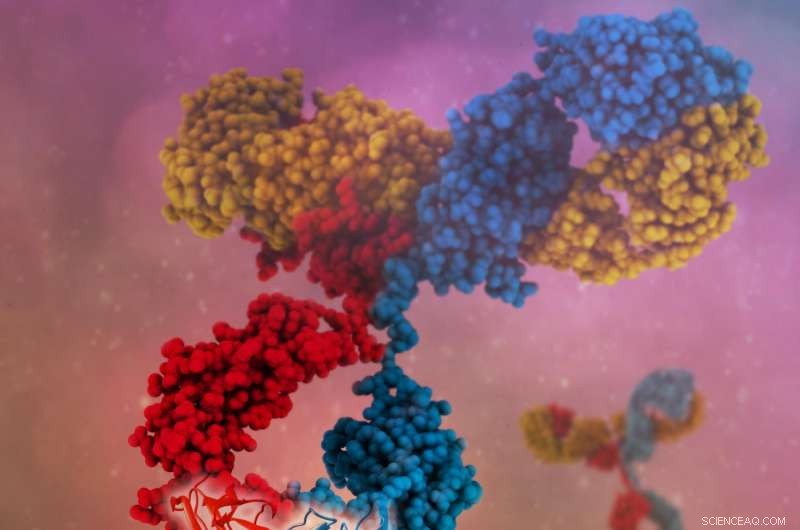
Een enkel bispecifiek antilichaam kan binden aan meerdere antigenen, wat resulteert in een meer specifieke targeting, nieuwe werkingsmechanismen en hogere klinische werkzaamheid. Krediet:Camilla De Nardis, Linda J.A. Hendriks, Emilie Poirier, Tudor Arvinte, Piet Gros, Alexander B.H. Bakker en John de Kruif
Een groep onderzoekers heeft een aanpak ontwikkeld om op efficiënte wijze antilichamen te produceren die tegelijkertijd aan twee verschillende doelmoleculen kunnen binden, een lang gewenste innovatie op het gebied van kankerimmunotherapie. De details zullen worden gepubliceerd in het nummer van 1 september van de Tijdschrift voor biologische chemie .
Antilichamen zijn eiwitten die door het immuunsysteem worden geproduceerd en die zijn gespecialiseerd in het herkennen en binden aan moleculaire doelwitten die uniek zijn voor bacteriën, virussen of andere vreemde cellen. Omdat antilichamen stabiel en langdurig in het menselijk lichaam zijn en specifieke doelen precies kunnen herkennen, ze zijn gebruikt om nieuwe behandelingen voor ziekten te ontwikkelen. Bijvoorbeeld, gemodificeerde antilichamen kunnen worden gebruikt om te binden aan doelen in kankercellen, het immuunsysteem aanwerven om de kanker aan te vallen of te voorkomen dat de kankercellen zich vermenigvuldigen. Vanwege hun precisie en vermogen om de immuunrespons van het lichaam te stimuleren, op antilichamen gebaseerde therapieën hebben doorgaans minder bijwerkingen dan chemotherapie of bestraling.
Antilichamen zijn "Y"-vormig, en binden meestal een doelwit, of antigeen, door de punt van elke arm van de "Y". In natuurlijk geproduceerde antilichamen, beide armen van een enkel antilichaam zijn typisch hetzelfde en binden aan hetzelfde doelwit. Een benadering om de veelzijdigheid van antilichaamtherapieën te vergroten, is het ontwikkelen van zogenaamde bispecifieke antilichamen, waarbij elke arm aan een ander molecuul bindt. Dit vergroot het bereik waarvoor antilichamen kunnen worden gebruikt. Bijvoorbeeld, een bispecifiek antilichaam kan zich richten op een cluster van eiwitten die uit meerdere eiwittypen bestaan, of het kan twee verschillende moleculen of celtypen bij elkaar brengen.
Eén bispecifiek antilichaamachtig medicijn - het leukemiemedicijn blinatumomab - is momenteel op de markt. Maar de ontwikkeling van meer therapieën op basis van bispecifieke antilichamen werd gehinderd door technische uitdagingen. Bijvoorbeeld, bepaalde bispecifieke antilichamen wijken af van de standaard Y-vorm en zijn doorgaans minder stabiel dan conventionele antilichamen, gemakkelijk uit elkaar vallen. Verder, bepaalde bispecifieke antilichaamformaten waren meestal moeilijk te produceren op industriële schaal omdat ze gespecialiseerde technische processen kunnen vereisen.
In experimenten gepubliceerd in JBC, een team onder leiding van John de Kruif, de chief technology officer van het klinische onderzoeksbedrijf Merus N.V., verbeterde bispecifieke antilichamen ontwikkeld door een paar belangrijke wijzigingen aan te brengen in de structuur van natuurlijke menselijke immunoglobuline G (IgG) -antilichamen, en toonde aan dat ze gemakkelijk konden worden vervaardigd. IgG is een goed bestudeerd antilichaam en is het meest voorkomende antilichaam dat in het menselijk lichaam wordt geproduceerd.
"We hebben gemaakt, in een compleet IgG-molecuul, slechts vier veranderingen om van een normaal monospecifiek antilichaam in een bispecifiek antilichaam te komen, " zei de Kruif. "Het mooie is dat het zo veel op een normaal antilichaam lijkt dat we het goed kunnen produceren en we denken te weten hoe het zich zal gedragen."
De vier mutaties zaten in de "zware keten" eiwitcomponenten van de antilichamen. Typisch, twee identieke zware ketens vormen een paren in elk antilichaam. De uitdaging bij het creëren van bispecifieke antilichamen was om niet-identieke zware ketens te laten paren - het creëren van "armen" die in staat zijn om verschillende antigenen te binden - terwijl het paren van identieke wordt ontmoedigd.
Het idee van het team was om aminozuren met tegengestelde ladingen te introduceren in de twee verschillende zware ketens, zodat identieke zware ketens elkaar zouden afstoten terwijl de positief en negatief geladen zware ketens elkaar zouden aantrekken. Om de juiste locaties te identificeren om deze heffingen in te voeren, ze gebruikten computersimulaties met behulp van virtuele screeningsoftware, gevolgd door validatie in het laboratorium.
"Het gebruik van de virtuele screeningsoftware zorgde voor een baseline, " zei Linda Kaldenberg-Hendriks van Merus, die het testen van de antilichamen leidde. "We hebben potentiële goede kandidaten geïdentificeerd voor ontwerpkeuzes in de sets met zware kettingen, genereerde vervolgens de eiwitten en karakteriseerde ze grondig. Toen we zagen dat ze zich gedroegen zoals we wilden, het was echt bevredigend."
Het team onderzocht ook de moleculaire structuur van de bispecifieke antilichamen, en bevestigde dat de mutaties resulteerden in slechts zeer subtiele veranderingen in de "ruggengraat" van de zware ketens, wat de stabiliteit van deze bispecifieke antilichamen kan verklaren.
"Een sterk punt [van deze studie] was om verschillende benaderingen te combineren, de computationele tools met de biochemie en structurele biologie, " zei Camilla De Nardis van Merus en de Universiteit Utrecht, die een co-hoofdauteur van de studie was.
De eiwitten die samenwerkten om bispecifieke antilichamen te vormen, met zeer weinig tot geen monospecifieke antilichamen in het mengsel. Het team onderwierp ze vervolgens aan een reeks tests, wat bevestigt dat ze even stabiel waren als normale IgG-antilichamen en vergelijkbare farmacokinetische eigenschappen hadden.
Omdat de productie en zuivering van IgG-antilichamen een beproefd industrieel proces is, het team zou fabrikanten eenvoudig de eiwitsequenties kunnen bieden die zijn aangepast met de belangrijkste veranderingen waardoor de eiwitten bispecifieke stoffen konden vormen. "We geloven dat we vrijwel elk bispecifiek antilichaam kunnen maken dat we willen, ', aldus Kaldenberg-Hendriks.
De bispecifieke antilichamen van het team die zich richten op kankercelgroeifactorcomplexen zijn nu in klinische proeven, met nog meer in de preklinische pijplijn. Het team is enthousiast over de mogelijkheid om het veelzijdige formaat aan te passen aan verschillende soorten therapieën.
"Antilichamen kunnen zo specifiek zijn, en je kunt ze aanpassen en afstemmen, " zei Kaldenberg-Hendriks. "Met bispecifieke antilichamen, we geloven dat we de affiniteiten van beide armen kunnen kiezen en ze in evenwicht kunnen brengen, zodat je je meer specifiek op tumoren kunt richten, en rekruteren ook andere cellen of moleculen om de tumorcellen aan te vallen zonder veel bijwerkingen. We denken echt dat dit de weg vooruit is."
 Poreuze materialen meten temperatuur op moleculair niveau
Poreuze materialen meten temperatuur op moleculair niveau Aantal protonen in een ongeladen Atom
Aantal protonen in een ongeladen Atom Waarom produceert citroenzuur elektriciteit?
Waarom produceert citroenzuur elektriciteit?  Celachtige lipideblaasjes die kunnen worden gevuld met natuurlijke celeiwitten
Celachtige lipideblaasjes die kunnen worden gevuld met natuurlijke celeiwitten Hydrogelblokjes ter grootte van een micron laten een zeer efficiënte afgifte zien van een krachtig geneesmiddel tegen kanker
Hydrogelblokjes ter grootte van een micron laten een zeer efficiënte afgifte zien van een krachtig geneesmiddel tegen kanker
 Welke dieren leven in aquatische habitats?
Welke dieren leven in aquatische habitats?  Opschudding terwijl Oeganda een plan nastreeft om waterval in nationaal park af te dammen
Opschudding terwijl Oeganda een plan nastreeft om waterval in nationaal park af te dammen Vlinders voor een verzameling doden
Vlinders voor een verzameling doden  Arctische fytoplankton-assemblages in kustwateren blijven productief, ondanks wisselende omgevingsomstandigheden
Arctische fytoplankton-assemblages in kustwateren blijven productief, ondanks wisselende omgevingsomstandigheden Stijgende oceaantemperaturen bedreigen zeegrasweiden en hun vermogen om koolstof vast te houden
Stijgende oceaantemperaturen bedreigen zeegrasweiden en hun vermogen om koolstof vast te houden
Hoofdlijnen
- Verrassende ontdekking - hoe de Afrikaanse tseetseevlieg echt je bloed drinkt
- Wat gebeurt er nadat u een wortel in zout water hebt gestopt?
- Studie vindt hoe de overlevingstijd van stamcellen kan worden verlengd
- Verschillen en overeenkomsten tussen eencellig en cellulair
- Syngenta schikt Amerikaanse boerenrechtszaken in Chinese maïshandelzaak
- Wat gebeurt er als mitose fout gaat en in welke fase gaat het fout?
De meeste cellen groeien en delen voortdurend. Een proces dat de celcyclus wordt genoemd, laat een cel groeien, zijn DNA dupliceren en delen. Celdeling gebeurt via een ander proc
- Waarom kunnen we de voetstappen van anderen horen,
- Worden we echt wijzer met de jaren?
- Menselijke resten gevonden in grote Australische krokodil
- Nieuwe methode ziet vezels in 3D, gebruikt het om geleidbaarheid te schatten

- De kwaliteit van koolzaadolie behouden

- Materiaalwetenschappers bouwen een synthetisch systeem met compartimenten zoals echte cellen
- Op palladium gebaseerd metaalglas met hoge trombogene weerstand
- Nieuw op machine learning gebaseerd raamwerk kan leiden tot doorbraken in materiaalontwerp

 De waarneming van Kardar-Parisi-Zhang hydrodynamica in een kwantummateriaal
De waarneming van Kardar-Parisi-Zhang hydrodynamica in een kwantummateriaal Wat schattige honden ons kunnen leren over democratie
Wat schattige honden ons kunnen leren over democratie Innovatief model gemaakt voor NASA om vitamineniveaus in voedsel voor ruimtevluchten te voorspellen
Innovatief model gemaakt voor NASA om vitamineniveaus in voedsel voor ruimtevluchten te voorspellen Volkswagen besteedt 44 miljard euro aan elektrisch offensief
Volkswagen besteedt 44 miljard euro aan elektrisch offensief Gorilla Glass heeft versterkte bescherming voor telefoons om oh-no drops te overleven
Gorilla Glass heeft versterkte bescherming voor telefoons om oh-no drops te overleven Onderzoekers stellen nieuwe tijdlijn vast voor oud magnetisch veld op Mars
Onderzoekers stellen nieuwe tijdlijn vast voor oud magnetisch veld op Mars Illegale houtkap in Brazilië verandert Amazon in een kruitvat
Illegale houtkap in Brazilië verandert Amazon in een kruitvat Hoeveel land is nodig voor windturbines?
Hoeveel land is nodig voor windturbines?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

