
Wetenschap
Fonkelende enzymen zouden de weg kunnen banen naar betere kankermedicijnen
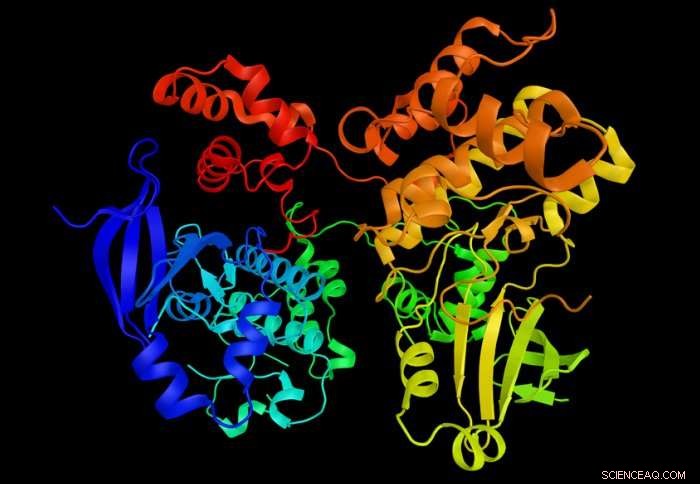
De nieuwe benadering onthult de toestand van eiwitkinasen (afgebeeld). Krediet:Imperial College London
Een nieuwe test om de eigenschappen van biologisch belangrijke enzymen aan te tonen, zou de ontwikkeling van nieuwe behandelingen kunnen helpen stroomlijnen.
"Twinkelen, twinkelen, weinig kinase. Hoe ik me afvraag in welke vorm je bent..."
Het is misschien niet het beste kinderliedje, maar een benadering die eiwitten ziet 'fonkelen' als sterren aan de nachtelijke hemel, geeft nieuw inzicht in een belangrijke klasse van enzymen die betrokken zijn bij ziekten.
Door de enzymen te taggen met fluorescerende kleurstoffen, onderzoekers van Imperial hebben nieuwe kenmerken kunnen onthullen, waarvan ze zeggen dat ze zouden kunnen helpen bij het ontwikkelen van betere medicijnen voor parasitaire infecties, ontstekingsziekte en kanker.
De enzymen, proteïnekinasen genoemd, helpen bij het reguleren van cellen en het coördineren van hun reacties op wat er om hen heen in het lichaam gebeurt. Ze zijn enorm belangrijk bij celsignalering en alarmeren wanneer het DNA van de cel is beschadigd, de reactie uitlokken.
Echter, wanneer de enzymen fout gaan, kunnen ze stroomafwaarts een hele reeks problemen veroorzaken - zoals ongecontroleerde groei, leiden tot tumoren - waardoor ze een aantrekkelijk doelwit zijn voor medicijnfabrikanten die nieuwe kankerbehandelingen ontwikkelen.
Uit eerder onderzoek naar hun structuur is gebleken dat de enzymen 'actieve' en 'inactieve' vormen hebben, afhankelijk van de vorm en positie van een 'activeringslus'. Achter dit, echter, het was niet mogelijk om te meten hoe de enzymen van toestand wisselden, of als ze een molecuul nodig hadden om te converteren, en het kan moeilijk zijn om hun toestand te stabiliseren.
Nutsvoorzieningen, een groep onder leiding van Dr. Charlotte Dodson, een research fellow in Imperial's National Heart and Lung Institute, heeft een manier gevonden om de verhouding tussen actieve en inactieve vormen aan te tonen en hoe het enzym verandert als reactie op moleculen en remmers.
"We weten al ongeveer 15 jaar uit kristalstructuren dat deze enzymen structureel in twee klassen vallen, " verklaarde Dr. Dodson. "In de actieve vorm, het enzym is 'klaar om te gaan' en zijn biologische functie uit te voeren, maar in zijn inactieve vorm is het niet in staat zijn werk te doen."
Schakeltoestanden
In samenwerking met het Instituut voor Kankeronderzoek, Het laboratorium van Dr. Dodson was in staat om fluorescerende markers te labelen aan twee verschillende regio's van het enzym.
Toen de enzymen in de actieve toestand waren, waren de kleurstofmoleculen ver uit elkaar en fluoresceerden, verschijnen als gloeiende stippen onder de microscoop. Toen de enzymen overschakelden naar de inactieve toestand, de twee regio's die met de kleurstof waren gelabeld, kwamen in nauw contact met elkaar, het doven van de kleurstof en het laten fonkelen van de fluorescentie.
Afhankelijk van of ze moleculen toevoegden die actieve of inactieve toestanden bevorderden, het team ontdekte dat ze het aandeel staten in een steekproef konden veranderen, en ze waren in staat om het te meten als een verandering in fluorescentie.
"Door fluorescentie te meten, we kunnen zien in welke vorm de kinasen zich bevinden, " zei Dr. Dodson. "Als we dit in de loop van de tijd continu doen en door een microscoop naar individuele moleculen kijken, het ziet eruit als een nachtelijke hemel met veel fonkelende kleine stippen.
"Omdat we de fluorescentie van individuele moleculen kunnen meten, we weten dat ze in oplossing veranderen, en dit is iets wat niemand eerder heeft kunnen doen."
Volgens de onderzoekers is in praktijk, de aanpak zou kunnen worden gebruikt om geneesmiddelen die zich op de enzymen richten te verfijnen door te laten zien hoe ze de mix van actieve en inactieve toestanden beïnvloeden.
Bijvoorbeeld, als een remmer een monster van kinasen naar 70 procent inactief 30 procent actief duwde, medicijnmakers zouden het molecuul kunnen aanpassen en de impact op een populatie kinasen kunnen meten. Als na het aanpassen van het medicijn de mix verandert in 90 procent inactief, het zou aantonen dat de remmer een groter effect heeft dan voorheen.
Kanker is momenteel het grootste doelwit voor kinaseremmers, met een markt die naar schatting $30 miljard (USD) of meer waard is, maar onderzoekers onderzoeken de rol van kinasen op andere gebieden, waaronder ziekten van het hart en de longen.
Dr. Dodson voegde toe:"We hebben de test ontwikkeld en een proof of principle uitgevoerd in een bepaalde kinase om te laten zien dat het werkt en om te onderzoeken wat er aan de hand is. De volgende stap is om dingen aan te pakken en dit toe te passen op andere interessante kinases .
"Ik denk dat naarmate meer en meer mensen beseffen dat deze enzymen belangrijk zijn bij andere ziekten, de opgedane kennis uit de oncologie kan worden overgedragen naar nieuwe therapiegebieden."
Ze voegde eraan toe:"Hoe meer informatie we kunnen verstrekken in de ontwerpfase van de ontwikkeling van geneesmiddelen, des te beter. Door deze aanpak te gebruiken, zouden we medicijnfabrikanten in staat kunnen stellen om nieuwe behandelingen efficiënter te ontwerpen, wat tijd en geld kan besparen. Het kan ertoe leiden dat nieuwe remmers sneller in de kliniek komen."
 Principes van stoomdestillatie
Principes van stoomdestillatie Polyethyleen Glycol Vs. Ethylene Glycol
Polyethyleen Glycol Vs. Ethylene Glycol Dansende materie:nieuwe vorm van beweging van cyclische macromoleculen ontdekt
Dansende materie:nieuwe vorm van beweging van cyclische macromoleculen ontdekt Kwantitatieve studie van het aldehydegehalte in elektronische sigaretten
Kwantitatieve studie van het aldehydegehalte in elektronische sigaretten Een nieuw MXene-materiaal vertoont een buitengewoon afschermend vermogen tegen elektromagnetische interferentie
Een nieuw MXene-materiaal vertoont een buitengewoon afschermend vermogen tegen elektromagnetische interferentie
 De effecten van vervuiling op het lichaam
De effecten van vervuiling op het lichaam  Canada's laatste intacte ijsplaat stort in door opwarming
Canada's laatste intacte ijsplaat stort in door opwarming Eenvoudige stappen naar klimaatbestendige boerderijen hebben een groot voordeel voor tropische boeren
Eenvoudige stappen naar klimaatbestendige boerderijen hebben een groot voordeel voor tropische boeren Feiten over dennennaalden
Feiten over dennennaalden  Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen
Waterstof is een van de toekomstige bestuurders van stookolie en milieuactivisten kunnen beide steunen
Hoofdlijnen
- 10 echt slimme mensen die echt domme dingen deden
- Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen
- Gerst is de smaak van de maand, aangezien nieuwe studie het eeuwenoude brouwdebat beslecht
- Worden we echt wijzer met de jaren?
- Wat doet het endoplasmatisch reticulum?
- Hoe gelukkig te zijn in een relatie
- Retrovirus versus DNA-virus
- Bijvangst verantwoordelijk voor achteruitgang Nieuw-Zeelandse zeeleeuw
- DNA-tests op albatrospoep onthullen geheim dieet van toproofdier
- Nanomaterialen met laserprinten
- Directe waarneming van desorptie van een smelt van lange polymeerketens

- Kunstmatig van kleur veranderend materiaal dat de huid van een kameleon nabootst, kan de versheid van zeevruchten detecteren
- Team ontwikkelt zeer rekbare hydrogels voor multimateriaal 3D-printen met hoge resolutie

- Onderzoeksgroep vindt manier om plastic afvalproducten om te zetten in vliegtuigbrandstof

 Onderzoekers vinden bewijs van eiwitvouwing op de plaats van intracellulaire druppeltjes
Onderzoekers vinden bewijs van eiwitvouwing op de plaats van intracellulaire druppeltjes Antartica, hart van de aarde heeft bescherming nodig:expert
Antartica, hart van de aarde heeft bescherming nodig:expert Californië verplicht 100 procent emissievrije busvloot
Californië verplicht 100 procent emissievrije busvloot Een lijnplot maken
Een lijnplot maken  Studie is getuige van de eerste momenten van het sterven van een ster tot in het kleinste detail
Studie is getuige van de eerste momenten van het sterven van een ster tot in het kleinste detail Nieuwe benadering biedt beelden van een enkele cel met micrometerresolutie via contrast op basis van thermische eigenschappen van cellen
Nieuwe benadering biedt beelden van een enkele cel met micrometerresolutie via contrast op basis van thermische eigenschappen van cellen Slimme algoritmen stimuleren de planning
Slimme algoritmen stimuleren de planning Het belang van planten en dieren in het menselijk leven
Het belang van planten en dieren in het menselijk leven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

