
Wetenschap
Genetische schakelaars bij kanker nader bekijken
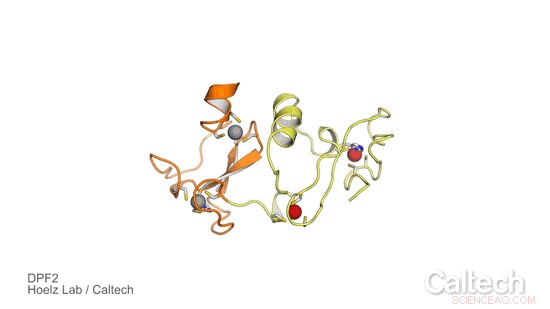
Een kristalstructuur van een deel van menselijk DPF2, een eiwit dat een genetische schakelaar aanstuurt die bloedstamcellen vertelt wanneer ze rode en witte bloedcellen moeten worden. Oranje en gele gebieden illustreren het DPF2 'reader'-domein, die wordt gestabiliseerd door zinkionen, weergegeven als rode en grijze bollen. Krediet:Hoelz Lab/Caltech
Tijdens de ontwikkeling van kanker gaan er veel dingen mis in cellen. De kern van de chaos zijn vaak genetische schakelaars die de productie van nieuwe cellen regelen. Bij een bijzonder agressieve vorm van leukemie, acute myeloïde leukemie genoemd, een genetische schakelaar die de rijping van bloedstamcellen in rode en witte bloedcellen regelt, gaat mis. Normaal gesproken, deze omschakeling leidt tot het juiste aantal witte en rode bloedcellen. Maar patiënten met acute myeloïde leukemie krijgen een gevaarlijke ophoping van bloedstamcellen en een tekort aan rode en witte bloedcellen - cellen die nodig zijn om het lichaam van zuurstof te voorzien en infecties te bestrijden.
Nutsvoorzieningen, onderzoekers van Caltech en het Sylvester Comprehensive Cancer Center van de Universiteit van Miami zoeken naar een eiwit dat helpt bij het beheersen van deze genetische omschakeling. Bij gezonde individuen, het eiwit, genaamd DPF2, stopt de aanmaak van rode en witte bloedcellen wanneer deze niet vervangen hoeven te worden. Dat is, het zet de schakelaar uit. Maar het eiwit kan worden overgeproduceerd bij patiënten met acute myeloïde leukemie. Het eiwit zit eigenlijk op de schakelaar, voorkomen dat het weer aangaat om de bloedcellen naar behoefte aan te maken. Patiënten die overproductie van DPF2 hebben, hebben een bijzonder slechte prognose.
In een nieuwe studie, verschijnt in de week van 22 mei, 2017, in het journaal Proceedings van de National Academy of Sciences , demonstreren de onderzoekers nieuwe manieren om DPF2 te belemmeren, waardoor acute myeloïde leukemie mogelijk beter te behandelen is. Ze rapporteren nieuwe structurele en functionele details over een fragment van DPF2. Deze nieuwe informatie onthult doelen voor de ontwikkeling van medicijnen die de functie van het eiwit zouden blokkeren.
"Veel menselijke ziekten, inclusief kanker, ontstaan door defecte genetische schakelaars, " zegt André Hoelz, de corresponderende auteur van de studie. Hoelz is hoogleraar scheikunde aan Caltech, een Heritage Medical Research Institute (HMRI) onderzoeker, en een Howard Hughes Medical Institute (HHMI) Faculty Scholar. "Door op te helderen hoe ze werken met atomaire details, kunnen we beginnen met het proces van op maat gemaakte medicijnen om ze te inactiveren en in veel gevallen is dat een belangrijke stap op weg naar genezing."
Rode en witte bloedcellen worden voortdurend geregenereerd uit bloedstamcellen, die zich in ons beenmerg bevinden. Net als andere stamcellen, bloedstamcellen kunnen eeuwig leven. Pas als ze worden gedifferentieerd in specifieke celtypen, zoals rode en witte bloedcellen, dat ze dan sterfelijk worden, of het vermogen verwerven om na een bepaalde tijd te overlijden.
"Ons lichaam gebruikt een complexe reeks genetische schakelaars om een bloedstamcel te differentiëren in veel verschillende celtypen. Deze gedifferentieerde cellen circuleren vervolgens in het bloed en hebben verschillende functies. Wanneer deze cellen het einde van hun levensduur bereiken, moeten ze vervangen worden, ", zegt Hoelz. "Dit is een beetje zoals het vervangen van gebruikte banden op een auto."
Om de rol van DPF2 te onderzoeken en meer te weten te komen over hoe het de genetische schakelaar voor het maken van bloedcellen regelt, de Hoelz-groep samen met Stephen D. Nimer, co-corresponderende auteur van het artikel en directeur van het Sylvester Comprehensive Cancer Center, en zijn team. Eerst, Ferdinand Huber en Andrew Davenport - beide afgestudeerde studenten aan Caltech in de Hoelz-groep en co-eerste auteurs van de nieuwe studie - verkregen kristallen van een deel van het DPF2-eiwit dat een domein bevat dat bekend staat als een PHD-vinger, wat staat voor planet homeodomein. Vervolgens gebruikten ze röntgenkristallografie, een proces waarbij eiwitkristallen worden blootgesteld aan hoogenergetische röntgenstralen, om de structuur van het PHD-vingerdomein op te lossen. De techniek werd uitgevoerd bij de Stanford Synchrotron Radiation Lightsource, met behulp van een speciale bundellijn van Caltech's Molecular Observatory.
De resultaten onthulden hoe DPF2 bindt aan een DNA-eiwitcomplex, het nucleosoom genoemd, om de productie van rode en witte bloedcellen te blokkeren. Het eiwit "leest" verschillende signalen die op het nucleosoomoppervlak worden weergegeven door een vorm aan te nemen die past bij verschillende modificaties op het nucleosoomcomplex, zoals de verschillende gevormde stukjes van een legpuzzel. Zodra het eiwit aan deze DNA-locus bindt, DPF2 zet de schakelaar uit die de differentiatie van bloedcellen regelt.
De volgende stap was om te kijken of DPF2 kon worden geblokkeerd in menselijke bloedstamcellen in het laboratorium. Sarah Groenblatt, een postdoctoraal medewerker in de groep van Nimer en co-eerste auteur van de studie, gebruikte de structurele informatie van de groep van Hoelz om een gemuteerde versie van het eiwit te maken. De Nimer-groep introduceerde vervolgens het gemuteerde eiwit in bloedstamcellen, en ontdekte dat het gemuteerde DPF2 niet langer aan het nucleosoom kon binden. Met andere woorden, DPF2 kon de schakelaar voor het maken van bloedcellen niet meer deactiveren.
"De gemuteerde DPF2 kon niet binden aan specifieke regio's in het genoom en kon de differentiatie van bloedstamcellen niet stoppen, ", zegt Huber. "Of DPF2 ook kan worden geblokkeerd bij de kankerpatiënten zelf, valt nog te bezien." De onderzoekers zeggen een structurele socket in DPF2, een van de puzzelstukachtige regio's die in de nieuwe studie zijn geïdentificeerd, is een goed doelwit voor kandidaat-geneesmiddelen.
 Wetenschappers bouwen waterstofsensor die leesbaar is met het blote oog
Wetenschappers bouwen waterstofsensor die leesbaar is met het blote oog Wat zijn drie hoofdelementen met de structuur van organische moleculen?
Wat zijn drie hoofdelementen met de structuur van organische moleculen?  Chemie zorgt voor een nieuwe voorraad van een veelbelovende kanker- en hiv-behandeling
Chemie zorgt voor een nieuwe voorraad van een veelbelovende kanker- en hiv-behandeling Nieuwe methode om malariabehandeling op grote schaal te produceren
Nieuwe methode om malariabehandeling op grote schaal te produceren COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze?
COVID-19-antilichaamtesten:hoe betrouwbaar zijn ze?
 Voor een lagere klimaatvoetafdruk, vegetarisch dieet verslaat lokaal
Voor een lagere klimaatvoetafdruk, vegetarisch dieet verslaat lokaal Verwacht meer dodelijke hitte van klimaatverandering, studie zegt:
Verwacht meer dodelijke hitte van klimaatverandering, studie zegt: Uit onderzoek blijkt dat radontestkits voor de korte termijn niet effectief zijn bij het meten van blootstelling aan radongas
Uit onderzoek blijkt dat radontestkits voor de korte termijn niet effectief zijn bij het meten van blootstelling aan radongas Typen ecosystemen
Typen ecosystemen Polen moet water besparen voor (niet-)regenachtige dagen
Polen moet water besparen voor (niet-)regenachtige dagen
Hoofdlijnen
- Waarom zetten we de radio zachter als we verdwaald waren?
- Wondgenezing of regeneratie - de omgeving beslist?
- Gaan roodharigen uitsterven?
- Hoe maak je een geweldige flessenraket ontworpen voor afstand
- Hoe toont hemoglobine de vier niveaus van eiwitstructuur?
- De levenscyclus van een rozenplant
- Welke combinatie van chromosomen resulteert in een jongen?
- Genetische studie onthult seksgeheimen van schimmels werpt licht op candidiasis
- Hoe een 3D-model van het ademhalingssysteem te maken
- Wetenschapper vindt manier uit om kunstmatige fotosynthese op gang te brengen om lucht te zuiveren

- Bio-geïnspireerd enzymmodel met een redox-schakelaar
- Studie biedt nieuwe aanwijzingen voor het verbeteren van chemotherapie
- Natuurkundigen werpen röntgenlicht op smeltende polymeren

- Onderzoekers in West Virginia gebruiken neutronen om materialen te bestuderen voor verbeteringen aan energiecentrales

 Soorten maden
Soorten maden  Onderzoekers stellen een nieuwe database samen met uitvoerbare Python-codefragmenten op GitHub
Onderzoekers stellen een nieuwe database samen met uitvoerbare Python-codefragmenten op GitHub Warmteminnende Australische mieren geloven in diversiteit, hint 74 soorten nieuw voor de wetenschap
Warmteminnende Australische mieren geloven in diversiteit, hint 74 soorten nieuw voor de wetenschap Flexibele circuits afstemmen met licht
Flexibele circuits afstemmen met licht Voordelen en nadelen van multidimensionale schalen
Voordelen en nadelen van multidimensionale schalen  Nieuwe uitbarsting gedetecteerd van een lichtgevende superzachte bron in een nabijgelegen melkwegstelsel
Nieuwe uitbarsting gedetecteerd van een lichtgevende superzachte bron in een nabijgelegen melkwegstelsel Onderzoekers gebruiken op DNA gebaseerde nano-pincetten om de krachten tussen nucleosomen te meten
Onderzoekers gebruiken op DNA gebaseerde nano-pincetten om de krachten tussen nucleosomen te meten Het deksel optillen op siliconenbatterijen
Het deksel optillen op siliconenbatterijen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

