
Wetenschap
Internationale wetenschappelijke teams vinden mogelijke aanpak tegen parasieten
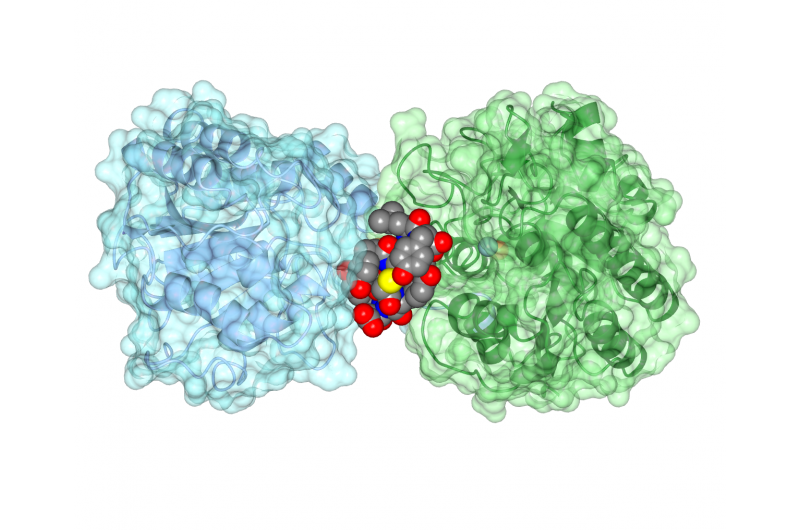
Het cyclische peptide ipglycermide bindt aan een iPGM-enzym, zijn activiteit blokkeren. Krediet:Jim Inglese, NCATS
Onderzoeksteams van de National Institutes of Health en in het buitenland hebben de eerste remmer van een enzym geïdentificeerd dat lang werd beschouwd als een potentieel medicijndoelwit voor de bestrijding van ziekteverwekkende parasieten en bacteriën. De teams, geleid door NIH's National Center for Advancing Translational Sciences (NCATS) en wetenschappers van de Universiteit van Tokyo, gesorteerd door meer dan 1 biljoen kleine eiwitfragmenten, cyclische peptiden genaamd, om er twee te ontdekken die het enzym zouden kunnen uitschakelen. de bevinding, meldde 3 april 2017 in Natuurcommunicatie , het toneel zou kunnen vormen voor de potentiële ontwikkeling van nieuwe soorten antimicrobiële geneesmiddelen.
NCATS' expertise in een vroeg stadium, preklinische ontdekking van moleculen hielp de teams potentiële kandidaat-geneesmiddelen te vinden die implicaties zouden kunnen hebben voor miljoenen mensen over de hele wereld.
"Het werk is een uitstekende demonstratie van hoe NCATS haar missie levert om verbeteringen aan te brengen in translationele processen, " zei Anton Simeonov, doctoraat, wetenschappelijk directeur, NCATS-divisie van preklinische innovatie. "Wetenschappers hebben aangetoond dat een therapeutisch doelwit, die voorheen door farmaceutische bedrijven als onaanvaardbaar werden beschouwd, is eigenlijk medicamenteus via een niet-traditioneel therapeutisch middel."
Het doelenzym, cofactor-onafhankelijke fosfoglyceraatmutase (iPGM), komt voor in zowel parasieten als bacteriën. Verschillende soorten parasitaire rondwormen hebben iPGM, waaronder Brugia malayi en Onchocerca volvulus, die ongeveer 150 miljoen mensen infecteren die voornamelijk in tropische gebieden wonen. Deze parasieten kunnen verwoestende infectieziekten veroorzaken, zoals rivierblindheid. Het enzym wordt ook gevonden in bacteriën, waaronder Staphylococcus aureus, die de ziekenhuisinfectie MRSA (methicilline-resistente Staphylococcus aureus) kan veroorzaken, en Bacillus anthracis, die miltvuur veroorzaakt.
"Verschillende infectieuze organismen zijn potentieel vatbaar voor een iPGM-remmer, " zei co-corresponderende auteur James Inglese, doctoraat, regisseur, NCATS-laboratorium voor testontwikkeling en screeningtechnologie. "Het team noemde de remmer-peptiden 'ipglycermiden, ' die een krachtige klasse van iPGM-remmers vertegenwoordigen. In theorie, zo'n medicijn zou een breedspectrum antiparasitaire en antibacteriële behandeling kunnen worden."
Huidige anti-parasitaire medicijnen, zoals ivermectine, werken voornamelijk aan de vroege larvale stadia van de worm. Een dergelijke behandeling moet gedurende een decennium jaarlijks of halfjaarlijks worden gegeven. Voor jaren, wetenschappers hebben geprobeerd een effectiever medicijn te vinden dat ook werkte tegen de volwassen worm en de latere stadia van infectie. Eerdere studies door Inglese's medewerkers bij New England Biolabs in Ipswich, Massachusetts, toonde aan dat iPGM een van de vele essentiële enzymen is die de rondworm nodig heeft om te overleven. Het maakt deel uit van een algemeen biologisch proces genaamd glycolyse, die helpt om energie voor cellen te maken. Terwijl hetzelfde belangrijke proces plaatsvindt in menselijke cellen, het is afhankelijk van een andere vorm van het enzym. Als resultaat, een medicijn dat zich richt op iPGM en de rondworm doodt, zou waarschijnlijk de menselijke tegenhanger met rust laten. Zo'n medicijn zou in alle levensfasen van de worm kunnen werken, en de infectie kan mogelijk acuut worden behandeld, vergelijkbaar met een antibioticum. Echter, hun eerdere pogingen om een verbinding te vinden om het enzym te blokkeren zijn mislukt.
Enzymen zijn eiwitten die chemische reacties op gang brengen. De meeste enzymen hebben zakvormige "actieve plaatsen" waarin een molecuul past, en waarop het enzym inwerkt. Geneesmiddelen met kleine moleculen kunnen op actieve plaatsen passen en voorkomen, of remmen, het enzym zijn biologische werk kan doen. Maar iPGM en andere vergelijkbare enzymen zijn anders. iPGM heeft een kortstondige, tijdelijke actieve site, waardoor het praktisch onmogelijk is om een medicijn met een klein molecuul te vinden dat het enzym kan blokkeren.
Vanwege het ongebruikelijke ontwerp van het enzym, het door NCATS geleide team zocht een ander type medicijn dan de typische medicijnen met kleine moleculen. Inglese werkte samen met co-corresponderende auteur Hiroaki Suga, doctoraat, aan de Universiteit van Tokio, om een bibliotheekmengsel van meer dan 1 biljoen kleine peptiden te bouwen. Het team ging nog een stap verder, het toevoegen van een aminozuur aan de peptiden om ringvormige cyclische peptiden te creëren, waarvan de wetenschappers veronderstelden dat ze de benodigde vorm en structuur zouden hebben om zich aan het enzymoppervlak te hechten en het enzym uit te schakelen.
De onderzoekers doorzochten herhaaldelijk de cyclische peptiden om te vinden welke het meest hecht aan het enzym. Ze vonden twee cyclische peptiden die beide stevig aan alleen het iPGM-enzym bonden en ook de activiteit ervan stopten.
Het team werkte vervolgens samen met structurele biologen aan de Universiteit van Kansas, Laurens, om de structuur van de iPGM-cyclische peptide-rangschikking te bepalen, laten zien hoe het peptide ervoor zorgde dat het enzym niet goed werkte. "Het cyclische peptide heeft een verbazingwekkend strakke en selectieve affiniteit voor iPGM, als een antilichaam, ' zei Inglese.
De volgende stappen van de groep zullen zijn om manieren te vinden waarop cyclische peptiden cellen kunnen binnendringen. "Als we manieren kunnen vinden om cyclische peptiden in cellen te stoppen, dan zou dit nieuwe doelwitten openen die kleine moleculen moeilijk aan te pakken hebben, " zei Inglese. "Ipglycermiden vertegenwoordigen een vruchtbaar maar onontgonnen landschap tussen geneesmiddelen met kleine moleculen en biologische eiwitten."
 Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen Op fosfor gebaseerde composieten als anodematerialen voor kalium-ionbatterijen
Op fosfor gebaseerde composieten als anodematerialen voor kalium-ionbatterijen Belang van water in dierenleven
Belang van water in dierenleven Superstaalproject bereikt grote doorbraak
Superstaalproject bereikt grote doorbraak ORNL bereikt belangrijke FDA-mijlpaal voor kankerbestrijdende Ac-225-isotoop
ORNL bereikt belangrijke FDA-mijlpaal voor kankerbestrijdende Ac-225-isotoop
 Instructies voor een Egg Drop Science Fair Project
Instructies voor een Egg Drop Science Fair Project Galapagos Penguin Feiten voor kinderen
Galapagos Penguin Feiten voor kinderen  Hoe vulkanen op aarde een venster bieden op de evolutie van het leven en het zonnestelsel
Hoe vulkanen op aarde een venster bieden op de evolutie van het leven en het zonnestelsel Giftige fluorkoolwaterstoffen om ons water (en lichaam) schoon en gezond te houden
Giftige fluorkoolwaterstoffen om ons water (en lichaam) schoon en gezond te houden VN:Overstromingen in centraal Somalië raken bijna 1 miljoen mensen
VN:Overstromingen in centraal Somalië raken bijna 1 miljoen mensen
Hoofdlijnen
- Uitleg van celspecialisatie
- Wanneer dupliceren chromosomen tijdens een cellevenscyclus?
- Fotograaf legt menselijk gezicht van bedreigde diersoorten vast
- Wat zijn de vier macromoleculen van het leven?
- Op de vleugels van Lepidoptera
- Componenten van Homeostasis
- Waarom is fotosynthese belangrijk voor mensen?
- Een betere manier om pesticiden van appels te wassen
- Het bestuderen van circadiane ritmes in planten en hun ziekteverwekkers kan leiden tot precisiegeneeskunde voor mensen
- Hooggevoelige nanofotonische sensoren met passieve opsluiting van analytmoleculen in hotspots

- Polymeren met verschillende lengtes kweken

- Experimentele studie van hoe metallisch glas een uitdaging vormt voor het paradigma in glasonderzoek

- Zelfmontage vereist:neutronen onderzoeken nieuw polymeergedrag voor biomedische materialen

- Nanostructurering verhoogt de efficiëntie van metaalvrije fotokatalysatoren met een factor 11

 Inhoud van de aardappel die elektriciteit kan geleiden
Inhoud van de aardappel die elektriciteit kan geleiden  Wat zijn de effecten van uitloging?
Wat zijn de effecten van uitloging?  Opto-mechanische niet-wederkerigheid in vezel
Opto-mechanische niet-wederkerigheid in vezel Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst
Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst Verborgen informatie in geluidsgolven onthullen
Verborgen informatie in geluidsgolven onthullen Kan ik een zaklampstraal van de aarde op de maan zien?
Kan ik een zaklampstraal van de aarde op de maan zien?  Nieuwe techniek onthult 3D-vorm van polariton-interactie van nanostructuren
Nieuwe techniek onthult 3D-vorm van polariton-interactie van nanostructuren Hoe verschillen spanningspieken en -pieken?
Hoe verschillen spanningspieken en -pieken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Swedish | German | Dutch | Danish | Norway | Italian | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

