
Wetenschap
Een heroverweging van ziekten in het licht van fasescheiding en faseovergang kan noodzakelijk zijn
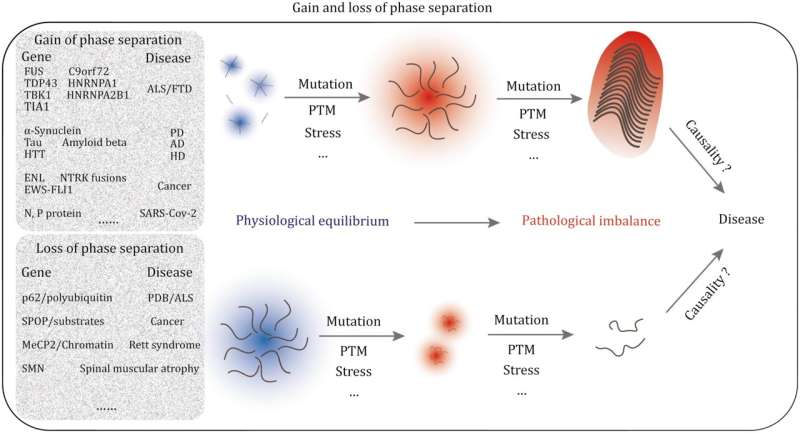
Neurodegeneratieve ziekten zoals ALS, FTD en andere vormen een steeds zwaardere last voor de mondiale gezondheidszorgsystemen. Onder deze omstandigheden ondergaan eiwitten zoals TDP-43, FUS, Tau, hnRNPA1, hnRNPA2B1 en polyQ-bevattende eiwitten een abnormale fasescheiding, wat onomkeerbare biofysische veranderingen teweegbrengt. Het ontrafelen van de mechanismen achter afwijkende fasescheiding biedt een nieuw perspectief op het begrijpen van het ontstaan en de progressie van neurodegeneratieve ziekten.
Bij kanker verstoren ingewikkelde genetische mutaties de normale fasescheidingsprocessen, waardoor tumorvorming wordt gestimuleerd. Opmerkelijke voorbeelden zijn onder meer fusiegenen bij leukemie en fusie-eiwitten in sarcomen, die significante verschuivingen in de stroomafwaartse genregulatie veroorzaken en kwaadaardige tumorgroei bevorderen. Het aanpakken van afwijkende fasescheiding biedt een nieuwe manier om kanker te begrijpen en mogelijk te behandelen.
Ziekteverwekkers maken gebruik van biomoleculaire condensaten om de infectiviteit te versterken, terwijl het immuunsysteem van de gastheer fasescheiding gebruikt om ziekteverwekkers te identificeren en te neutraliseren. Virale eiwitten orkestreren de vorming van replicatiecentra of inclusielichamen, die cruciaal zijn voor virale replicatie en assemblage, waardoor de virale infectiviteit wordt versterkt. Inzicht in de dynamiek van fasescheiding tijdens infectie werpt licht op gastheer-pathogeen interacties en immuunreacties, wat mogelijk de ontwikkeling van antivirale strategieën vergemakkelijkt.
De huidige therapeutische benaderingen richten zich zowel op de "controllers" als de "drivers" van vloeistof-vloeistoffasescheiding (LLPS). Controllers, die structurele eiwitten zoals enzymen, celoppervlakreceptoren en transcriptiefactoren omvatten, ondergaan regulatie via signaalroutes en post-translationele modificaties.
Ondertussen spelen factoren, zoals specifieke intrinsiek ongeordende eiwitten (IDP's) en nucleïnezuren, een cruciale rol in LLPS. Innovatieve platforms voor het screenen van geneesmiddelen, zoals DropScan, zijn veelbelovend voor het identificeren van verbindingen die in staat zijn afwijkende fasescheidingen bij ziekten zoals kanker te moduleren. Diepere inzichten in de condensaatbiologie zijn absoluut noodzakelijk voor het effectief manipuleren van voorbijgaande assemblages voor therapeutische doeleinden.
De review concludeert dat het veld van biomoleculaire condensatie en fasescheiding snel evolueert, wat nieuwe inzichten oplevert in ziektemechanismen en potentiële therapeutische strategieën. Lopend onderzoek biedt veelbelovende perspectieven voor transformatieve therapieën, waardoor onze benadering van ziektebehandeling en patiëntenzorg opnieuw vorm krijgt. Het werk met de titel "Long way up:rethink ziekten in het licht van fasescheiding en faseovergang" werd gepubliceerd op Protein &Cell .