
Wetenschap
Onderzoekers onthullen hoe acetylering de centromeerdynamiek, chromosoomsegregatie en mitotische progressie reguleert
Celdeling produceert nieuwe cellen, die de proliferatie en ontwikkeling van het leven ondersteunen. Mitose is de kortste en meest dynamische fase van de celcyclus. Tijdens de mitose worden de chromosomen gelijkmatig verdeeld tussen de twee dochtercellen, waardoor de integriteit van het genoom behouden blijft.
De centromeer, een gespecialiseerd gebied van het chromosoom, dient als rekruteringsplatform voor diverse eiwitten die cruciaal zijn voor het behouden van de cohesie van zusterchromatiden en voor de assemblage van kinetochoren. Deze kinetochoren zijn verantwoordelijk voor de aanhechting van spilmicrotubuli, die chromosoomcongressie en goede segregatie tijdens celdeling mogelijk maken.
Defecten in de structuur of functie van het centromeer kunnen leiden tot chromosoom-misegregatie, wat op zijn beurt kan resulteren in genomische instabiliteit.
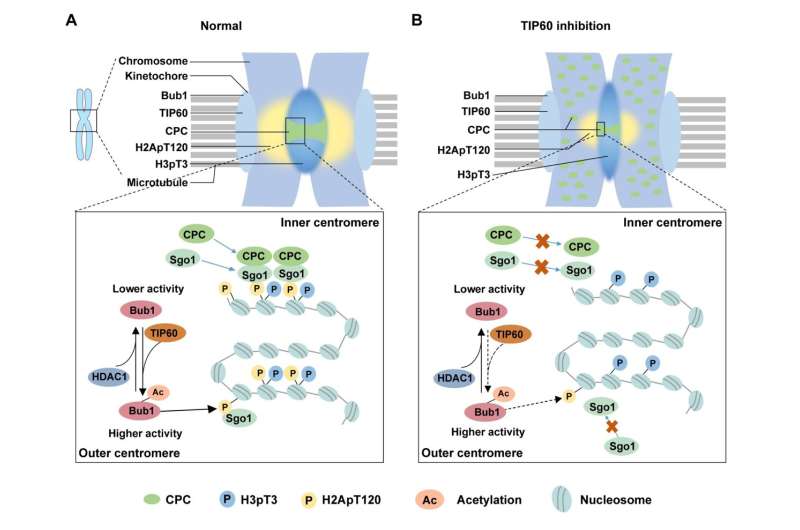
Bub1 (Budding Uninhibited by Benzimidazool 1) is een serine/threoninekinase die diverse functies vervult tijdens mitose. Het wordt gerekruteerd naar niet-gebonden kinetochoren tijdens de prometafase en bevordert de rekrutering van andere stroomafwaartse eiwitten naar de kinetochoren en centromeren.
Eiwitacetylering is een geconserveerde post-translationele modificatie die voorkomt in zowel prokaryoten als eukaryoten. In 1964 ontdekten onderzoekers voor het eerst de acetylering van histonen. Daaropvolgende studies hebben aangetoond dat niet alleen histonen, maar ook talrijke niet-histoneiwitten onderhevig zijn aan acetyleringsmodificaties, die betrokken zijn bij de regulatie van verschillende cellulaire levensactiviteiten.
Prof. Chuanmao Zhang en collega's van de Kunming Universiteit voor Wetenschap en Technologie en de Universiteit van Peking hebben een moleculair mechanisme gevonden dat de chromosoomcongressie en -segregatie reguleert. Dat hebben de onderzoekers aangetoond in hun artikel gepubliceerd in Science China Life Sciences acetyleert TIP60 Bub1 op K424 en K431 op kinetochoren tijdens vroege mitose, wat de kinase-activiteit van Bub1 verbetert.
"Toen we de mitotische geacetyleerde eiwitten verrijkten, ontdekten we onder hen Bub1", zegt Mengjie Sun, de eerste auteur van het artikel. "Bovendien hebben we tijdens de vroege mitose een significante stijging van het acetyleringsniveau van Bub1 waargenomen. Dit suggereert dat Bub1-acetylering een rol zou kunnen spelen in het proces."
Dit is het begin van hun onderzoek. En vervolgens ontdekten ze door een reeks experimenten, waaronder live cell imaging en biochemische technieken, dat Bub1-acetylering essentieel is voor een goede chromosoomcongressie en segregatie. Een verminderde Bub1-acetylering veroorzaakt een aanzienlijke vertraging in de uitlijning van de chromosomen en defecten in de chromosoomsegregatie, waaronder achterblijvende chromosomen en vorming van anafasebruggen.
Vervolgens hebben ze via in vivo en in vitro experimenten vastgesteld dat acetyltransferase TIP60 verantwoordelijk is voor de Bub1-acetylering.
Bovendien hebben de onderzoekers onderzocht hoe Bub1-acetylering, gemedieerd door TIP60, de chromosoomcongressie en -segregatie reguleert. Ze ontdekten de impact op de rekrutering van stroomafwaartse eiwitten naar de centromeren en ontdekten dat de CPC-componenten en Sgo1 niet effectief konden worden gerekruteerd naar de centromeren toen de Bub1-acetylering werd verstoord.
Eerdere studies hebben gemeld dat Bub1 H2A fosforyleert op T120 (H2ApT120) om CPC en Sgo1 te rekruteren. De onderzoekers probeerden vervolgens te bepalen hoe Bub1-acetylering het niveau van H2ApT120 beïnvloedt. Zoals ze verwachtten, verbetert Bub1-acetylering de kinase-activiteit, waardoor de fosforylatie van H2A wordt bevorderd.
"Dit is het mechanisme waarmee Bub1-acetylering de chromosoomcongressie en -segregatie reguleert", concludeerde prof. Zhang.
Aangezien de acetylering van Bub1 een dynamisch proces is gedurende de hele celcyclus, probeerden ze ook het enzym te identificeren dat verantwoordelijk is voor de deacetylering van Bub1. Ze identificeerden een essentieel deacetylase, HDAC1, dat de deacetylering van Bub1 bemiddelt wanneer cellen de mitose verlaten. Voortijdige deacetylering van Bub1 door HDAC1 kan de kinase-activiteit van Bub1 aantasten en leiden tot abnormale demontage van centromeren en misegregatie van chromosomen.
"Dit vormt een acetylerings- en deacetyleringscyclus van Bub1 in de celcyclus", legt Dr. Biying Yang uit.