
Wetenschap
Virussen herbedraden cellulaire machines van de gastheer om de virale productie te maximaliseren
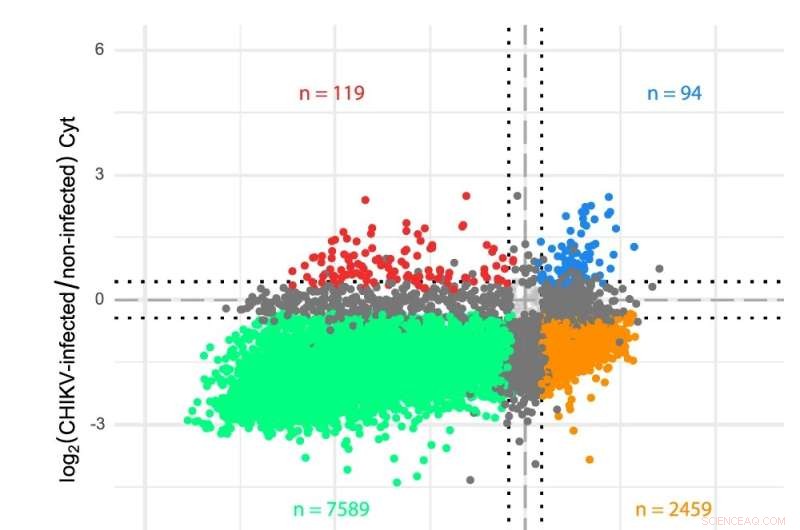
een schema van het CHIKV-RNA-genoom. b Transcriptoomanalyses van de cytosol- (Cyt) en ER-compartimenten in met CHIKV geïnfecteerde cellen. Genen werden uitgezet volgens hun log2-voudige veranderingen in CHIKV-geïnfecteerde versus niet-geïnfecteerde cellen voor beide translatiecompartimenten. De sequentielezingen werden geanalyseerd met behulp van een aangepaste transcriptoomannotatie en differentiële expressie werd bepaald via limma-voom (zie Methoden). Kleuren geven genen aan die significant (FDR < 0,05) neerwaarts gereguleerd zijn in beide compartimenten (groen), opwaarts gereguleerd in beide compartimenten (blauw), op- of neerwaarts gereguleerd in slechts één compartiment (donkergrijs) of tegengesteld gedrag vertonen in de twee compartimenten (oranje en rood). Gestippelde lijnen geven log2-voudige veranderingen aan van ± 0,433 (d.w.z. een verandering van 35% in beide richtingen) die worden gebruikt als minimumdrempel om mRNA-niveaus als gewijzigd aan te geven. HEK 293T-cellen werden geïnfecteerd met een MOI van 4 en monsters werden twaalf uur na infectie verzameld. Voor elke aandoening werden drie onafhankelijke replicaties uitgevoerd. Krediet:Natuurcommunicatie DOI:10.1038/s41467-022-31835-x
De Molecular Virology Research Group aan de Pompeu Fabra University (UPF), in samenwerking met de Epitranscriptomics and RNA Dynamics-groep van het Centre for Genomic Regulation (CRG), heeft een nieuw mechanisme ontdekt waarbij virussen de cellulaire machinerie aanpassen om de instructies in het genoom beter te kunnen lezen van het binnenvallende virus en produceren zo grote hoeveelheden viraal nageslacht. Het onderzoek is gepubliceerd in Nature Communications en werd geleid door Juana Diez.
Genen bevatten de informatie die nodig is voor de vorming van eiwitten, complexe moleculen die essentieel zijn voor het leven, gevormd uit aminozuren. Het lezen van deze informatie vindt plaats in twee hoofdfasen, met als eerste transcriptie, waarbij de informatie van het gen (DNA) wordt overgebracht naar een molecuul dat boodschapper-RNA (mRNA) wordt genoemd. mRNA bestaat uit een "tekst" gevormd door tripletten van nucleotiden (de letters GCT, CAT, enz.). Elk triplet komt overeen met een aminozuur. De tweede fase is translatie, waarbij een molecuul genaamd transfer-RNA (tRNA) elk triplet herkent en als vertaler fungeert door het overeenkomstige aminozuur te brengen. Via dit proces worden eiwitten opgebouwd.
Er zijn 61 codons en 20 aminozuren, en zoveel tripletten coderen voor hetzelfde aminozuur. Elk organisme gebruikt bij voorkeur een van deze tripletten (optimale triplet) omdat het een hogere concentratie van het tRNA heeft dat dat triplet herkent. Dus wanneer de "tekst" van het mRNA wordt verrijkt in optimale tripletten, zullen de eiwitten snel en efficiënt worden gegenereerd, terwijl wanneer ze worden verrijkt in niet-optimale tripletten, de efficiëntie van de expressie zal afnemen omdat de gerelateerde tRNA's schaars zijn.
Virussen zijn heel eenvoudig en om hun eiwitten te vermenigvuldigen en tot expressie te brengen, moeten ze de cellulaire machinerie van de gastheer kapen. Virussen genereren hun eigen mRNA in de cellen die ze infecteren, die deze laatste lezen en genereren virale eiwitten om meer virussen te produceren. Maar de mRNA's van veel virussen, waaronder SARS-CoV-2 en virussen die worden overgedragen door muggen dengue, zika en chikungunya, zijn verrijkt met niet-optimale tripletten en brengen nog steeds met grote werkzaamheid virale eiwitten tot expressie. "Om dit dilemma aan te pakken, hebben we het chikungunya-virus als model gebruikt omdat het genoom zich op extreem hoge niveaus vermenigvuldigt", leggen Jennifer Jungfleisch en René Böetcher, co-auteurs van het onderzoek, uit.
"Onze bevindingen laten voor de eerste keer zien dat virussen het gastheer-tRNA wijzigen om de gastheertranslatiemachinerie aan te passen aan de tekst van het virale mRNA", zegt Marc Talló, ook co-auteur van het artikel. "Met andere woorden, de virale infectie veroorzaakt een verandering van taal in de cel, zodat deze de virale eiwitten zeer efficiënt tot expressie brengt. Aangezien virale eiwitten essentieel zijn voor de productie van virussen, zal deze verandering uiteindelijk verantwoordelijk zijn voor het genereren van grote aantallen virussen in de geïnfecteerde cel", voegt hij eraan toe.
"Hoewel de studie zich heeft gericht op het chikungunya-virus, is ons voorstel dat de modificatie van tRNA's die wordt veroorzaakt door virale infectie een algemeen mechanisme is dat wordt gevolgd door veel virussen", legt Juana Díez uit, een hoogleraar bij de UPF-afdeling Geneeskunde en Levenswetenschappen.
"Bovendien bieden onze resultaten een basis om tRNA-regulatie te beschouwen als een nieuw en veelbelovend therapeutisch doelwit voor de ontwikkeling van breed-spectrum antivirale middelen die effectief zijn tegen meerdere virussen", besluit Díez. De studie omvatte ook de onderzoeksgroep gecoördineerd door Eva María Novoa van het CRG, en de andere auteurs zijn Gemma Pérez-Vilaró en Andres Merits (Instituut voor Technologie, Universiteit van Tartu). + Verder verkennen
Virussen passen zich aan aan 'taal van menselijke cellen' om eiwitsynthese te kapen
 Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen
Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen Een aardappellamp maken
Een aardappellamp maken De studie van niet-covalente intermoleculaire interacties naar een nieuw gebied duwen
De studie van niet-covalente intermoleculaire interacties naar een nieuw gebied duwen Onderzoekers ontwikkelen een unieke methode om 3D poreuze structuren te fabriceren
Onderzoekers ontwikkelen een unieke methode om 3D poreuze structuren te fabriceren Upcycling van plastic zakken tot batterijonderdelen
Upcycling van plastic zakken tot batterijonderdelen
 Braziliaanse rechtbank blokkeert verhuizing om mangrovebescherming in te trekken
Braziliaanse rechtbank blokkeert verhuizing om mangrovebescherming in te trekken Wanneer een stip een storm beïnvloedt
Wanneer een stip een storm beïnvloedt Oude Mesopotamische moerassen bedreigd door Iraaks rioolwater, verontreinigende stoffen
Oude Mesopotamische moerassen bedreigd door Iraaks rioolwater, verontreinigende stoffen Belang van de oostelijke woestijn in het oude Egypte
Belang van de oostelijke woestijn in het oude Egypte NASA's Aqua-satelliet toont windschering die tropische cycloon Riley beïnvloedt
NASA's Aqua-satelliet toont windschering die tropische cycloon Riley beïnvloedt
Hoofdlijnen
- Wat zijn de kleine delen van het DNA die Code for a Trait?
- Dode bomen leven met schimmels
- Hebben alle cellen mitochondriën?
- 10 bizarre behandelingen die artsen vroeger dachten dat ze legitiem waren
- Bacteriële virussen blijken interactie te hebben met menselijke cellen, studie vondsten
- Hoe LEGO DNA-modellen te maken
- Wetenschappers ontgrendelen de code om betere erwten te kweken
- Research Paper Topics in Biochemistry
- Hoe schimmels fruitvliegen manipuleren om sporen te ontvangen en vrij te geven?
- Sommige commerciële ontsmettingsmiddelen werken mogelijk niet zo goed tegen het norovirus als oorspronkelijk werd gedacht

- Onderzoeker bestudeert vogels die alle paringsregels overtreden

- De allereerste tagging van Amazone-dolfijnen om de inspanningen voor natuurbehoud te stimuleren

- Zeeleeuwen hebben unieke snorharen waarmee ze zelfs de snelste vis kunnen vangen

- Bosplantages zijn een krachtige melange voor de koffieproductie

 Wetenschappers ontwikkelen actieve en slimme terahertz elektro-optische modulator
Wetenschappers ontwikkelen actieve en slimme terahertz elektro-optische modulator Conflicten op de kleuterschool kunnen de interesse van kinderen in lezen en rekenen verminderen
Conflicten op de kleuterschool kunnen de interesse van kinderen in lezen en rekenen verminderen Bacterieel enzym kan een nieuw doelwit worden voor antibiotica
Bacterieel enzym kan een nieuw doelwit worden voor antibiotica Elektronische huid opgerekt tot nieuwe grenzen
Elektronische huid opgerekt tot nieuwe grenzen Draagt sommige donkere materie een elektrische lading?
Draagt sommige donkere materie een elektrische lading? Hoe maak je een Dinosaur Diorama
Hoe maak je een Dinosaur Diorama  Hoe snel kunnen bosbranden zich verspreiden?
Hoe snel kunnen bosbranden zich verspreiden?  Onhoorbaar infrageluid ook nuttig voor weers- en klimaatvoorspellingen
Onhoorbaar infrageluid ook nuttig voor weers- en klimaatvoorspellingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

