
Wetenschap
Voor de eerste keer, onderzoekers meten eigenschappen van water bij diep onderkoelde temperaturen

Water is anders dan andere stoffen omdat zijn vaste vorm -- zoals deze ijsberg -- minder dicht is dan zijn vloeibare vorm -- zoals deze oceaan. Wetenschappers bestuderen andere vreemde eigenschappen van water. Krediet:Wikimedia Commons
Water heeft veel ongewone eigenschappen, zoals zijn vaste vorm, ijs, in vloeibaar water kunnen drijven, en ze worden nog vreemder onder het vriespunt. Onderkoeld water - onder het vriespunt maar nog steeds een vloeistof - is notoir moeilijk te bestuderen. Sommige onderzoekers dachten dat onderkoeld water zich vreemd gedroeg binnen een bijzonder koud bereik, breken van een vloeistof in een vaste stof, onmiddellijk kristalliserend bij een bepaalde temperatuur als iets uit een Kurt Vonnegut-roman.
Nutsvoorzieningen, onderzoekers hebben een manier bedacht om snapshots te maken van bevriezend water binnen dat diep onderkoelde bereik. En raad eens? Water is niet zo raar als het zou kunnen zijn. Vloeibaar water kan helemaal naar beneden bestaan, langzamer kristalliseren tot een vaste stof naarmate de dingen kouder worden - zoals verwacht, maar nooit allemaal tegelijk.
Een team van onderzoekers van het Pacific Northwest National Laboratory van het Department of Energy rapporteerde het werk in deze week Proceedings van de National Academy of Sciences Vroege editie online. Hoewel de resultaten de manier waarop u uw ijsthee in de zomer maakt niet veranderen, het kan theoretici helpen hun begrip van water uit te werken en atmosferische wetenschappers helpen regen en wolken beter te begrijpen.
Een rare watertruc
De meeste mensen weten dat ijs drijft op vloeibaar water, maar ze zijn zich er misschien niet van bewust dat water moeite heeft om een glas te vormen. Een glas - zoals een raam - is een vaste stof waarin de moleculen zijn gerangschikt zoals ze in een vloeistof zouden zijn.
Neem een bos sinaasappels. Sinaasappels die losjes in een zak zijn door elkaar gegooid, zijn als een vloeistof - de afzonderlijke moleculen kunnen vrij vrij bewegen. Als je de sinaasappels netjes in een doos verpakt, je vormt een kristal. Als je de zak strak trekt en de door elkaar gegooide sinaasappels tegenhoudt, maar zonder ze netjes te ordenen, je vormt een glas.
Brillen zijn geweldig omdat ze verontreinigingen kunnen bevatten - denk aan een vlieg in barnsteen, of nucleair afval in verglaasd glas - terwijl kristallen verontreinigingen uitstoten - bevriezing van zeewater is een manier om het te ontzilten. Om een glas te maken, onderzoekers smelten zand of een ander bestanddeel tot het vloeibaar is. En dan koelen ze het zo snel af dat het geen kristal kan vormen voordat het stolt.
Maar bevries bulkwater snel en het vormt geen glas. Het wordt snel ijs. Glas worden, vloeibaar water moet binnen microseconden worden afgekoeld tot een temperatuur onder het vriespunt - ongeveer 136 Kelvin (ongeveer minus 215 graden F), een temperatuur die gebruikelijk is in de ruimte, waar sommigen glazig water verwachten.
Het moeilijk te bestuderen bereik ligt iets boven die zogenaamde glasovergangstemperatuur. Wetenschappers weten niet wat er gaande is tussen ongeveer 160 en 235 K. (In het echte leven, dat is tussen de temperatuur op Marsmaan Phobos en Fairbanks, Alaska, in de diepte van de winter.) Aan de bovenkant van dat bereik (dichter bij 235 K, Fairbanks), water bevriest van een onderkoelde vloeistof tot een kristal in milliseconden, wat veel te snel is voor de huidige analytische technieken om te bestuderen.
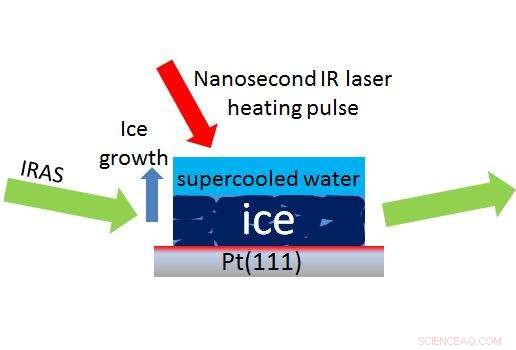
Een laser (rode pijl) creëert een kleine druppel onderkoeld water boven ijs, waardoor wetenschappers een methode genaamd IRAS (groene pijlen) kunnen gebruiken om in nanoseconden te meten hoe snel onderkoeld water weer in ijs verandert. Krediet:Kay, Kimmel/PNNL
Wetenschappers kwamen met verschillende ideeën om uit te leggen wat er in die onontgonnen regio aan de hand zou kunnen zijn. Ze vroegen zich af of het water metastabiel zou blijven - vloeibaar maar klaar om in een oogwenk te gaan kristalliseren - helemaal tot temperaturen waarbij het een glas wordt. Of als de vloeistof ergens warmer zou worden, rond 228 K (iets warmer dan de laagterecords op McMurdo Station op Antarctica), op welk punt het spontaan zou kristalliseren vanwege wat natuurkundigen een singulariteit noemen. Ook, er kan iets binnen dat bereik gebeuren dat kan helpen verklaren waarom water moeite heeft met het vormen van een glas.
"Er was een overvloed aan postulaten, maar een gebrek aan gegevens, " zei PNNL chemisch fysicus Bruce Kay.
"Ons doel was om een nieuwe techniek te ontwikkelen om supergekoelde waterfilms op nanoschaal snel te verwarmen en af te koelen. " zei PNNL-natuurkundige Greg Kimmel.
Het mysterie van binnen
Om de gegevens in dat onmeetbare bereik te krijgen, Kimmel en Kay werkten samen met Yuntao Xu, een laserexpert, en anderen bij PNNL en ontwikkelden een manier om water op nanoseconden tijdschalen met een laser te verwarmen en af te koelen. Met behulp van deze methode, de PNNL-wetenschappers maten hoe snel het onderkoelde water in kristallijn ijs werd omgezet naarmate de temperatuur daalde. De kristallisatietijd daalde van nanoseconden bij de hoogste temperaturen tot uren bij 126 K. Op geen enkel moment, vooral bij 228 K, brak het onderkoelde water in een kristal, de mogelijkheid van een singulariteit uitsluiten.
Om de singulariteit vanuit een andere hoek te zoeken, de onderzoekers onderzochten hoe snel de moleculen van onderkoeld water konden bewegen, en hoeveel dat veranderde toen het kouder werd. Als de singulariteit bestond, ze zouden verwachten dat de watermoleculen op een gegeven moment niet meer kunnen bewegen. Van het vriespunt tot het glaspunt, de moleculen bewogen langzamer en langzamer op een complexe maar continue manier. Algemeen, de relatie tussen de temperatuur en hoe snel de moleculen konden bewegen suggereerde geen singulariteit bij 228 K.
"We kunnen de singulariteit waarschijnlijk van tafel halen, " zei Kay van PNNL.
Bij elkaar genomen, de resultaten geven waardevol inzicht in het gedrag van water.
"Bijvoorbeeld, in de atmosferische chemie, onderkoelde waterdruppels worden gevonden in wolken. Er zijn vragen over hoe lang ze aanhouden, " zei Kimmel van PNNL.
 Wetenschappers ontdekken nieuw veld dat invloed heeft op het stollen van metalen
Wetenschappers ontdekken nieuw veld dat invloed heeft op het stollen van metalen Nieuwe DNA-database bij Rutgers-Camden om forensische wetenschap te versterken
Nieuwe DNA-database bij Rutgers-Camden om forensische wetenschap te versterken Nieuwe manier om teken af te stoten:hun speeksel opdrogen
Nieuwe manier om teken af te stoten:hun speeksel opdrogen Wat is het verschil tussen molaire massa en molecuulgewicht?
Wat is het verschil tussen molaire massa en molecuulgewicht?  Drugs zorgen ervoor dat ratten minder snel alcohol drinken
Drugs zorgen ervoor dat ratten minder snel alcohol drinken
 De ruimtelijke en temporele dimensies van landschapsdynamiek begrijpen
De ruimtelijke en temporele dimensies van landschapsdynamiek begrijpen Informatie over olievlekken voor kinderen
Informatie over olievlekken voor kinderen Op weg naar plasticvrije oceanen
Op weg naar plasticvrije oceanen OK computer:hoe AI zou kunnen helpen bij het voorspellen van naschokken van aardbevingen
OK computer:hoe AI zou kunnen helpen bij het voorspellen van naschokken van aardbevingen Wetenschappers onthullen hoe het historische CFC-verbod de planeet een kans gaf om tegen de opwarming van de aarde te vechten
Wetenschappers onthullen hoe het historische CFC-verbod de planeet een kans gaf om tegen de opwarming van de aarde te vechten
Hoofdlijnen
- Maagdelijke vrouwelijke spinnen gevonden bereid om zichzelf over te geven om levend te worden opgegeten door spinnetjes
- "What is Pascals Triangle?
- Wat zijn de speciale dingen die gebeuren wanneer cellen worden gesplitst?
- Hebben mensen en bananen echt 50 procent van hetzelfde DNA?
- Hoe werkt ATP?
- Twee fasen van fotosynthese
- Milieubeheer van inheemse naties bij het aanpakken van invasieve soorten
- Prokaryotische celstructuur
- Hoe levert embryologie bewijs voor evolutie?
- Het gemiddelde volume berekenen

- Team vindt een eenvoudiger optimaal detectieschema voor kwantumsensoren op korte termijn
- Wetenschappers vinden een manier uit om met een röntgenlaser attoseconde elektronenbewegingen te zien

- Mysterie van hoe sperma zwemt onthuld in wiskundige formule
- Studie gebruikt een elektrisch veld om magnetische eigenschappen te creëren in niet-magnetisch materiaal

 GPU-nieuws:tijd voor een nieuwe poging op een waferscale-computer
GPU-nieuws:tijd voor een nieuwe poging op een waferscale-computer Behandelde vezels reinigen met kleurstof verontreinigd water
Behandelde vezels reinigen met kleurstof verontreinigd water Onderzoekers vinden gedetineerde jongeren nog steeds optimistisch over de toekomst
Onderzoekers vinden gedetineerde jongeren nog steeds optimistisch over de toekomst Hoe ontstaan sterrenstelsels?
Hoe ontstaan sterrenstelsels?  Onderzoekers ontwikkelen chip die testen en traceren voor COVID-19 verbetert
Onderzoekers ontwikkelen chip die testen en traceren voor COVID-19 verbetert China's kunstmatige zon vestigt wereldrecord met 100 seconden steady-state high-performance plasma
China's kunstmatige zon vestigt wereldrecord met 100 seconden steady-state high-performance plasma Nanodeeltjes kunnen helpen bij beroertetherapie
Nanodeeltjes kunnen helpen bij beroertetherapie Huwelijksnaamspel:wat voor soort man zou de achternaam van zijn vrouw aannemen?
Huwelijksnaamspel:wat voor soort man zou de achternaam van zijn vrouw aannemen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

