
Wetenschap
Freeze-frame microscopie legt moleculen vast en laadt op DNA
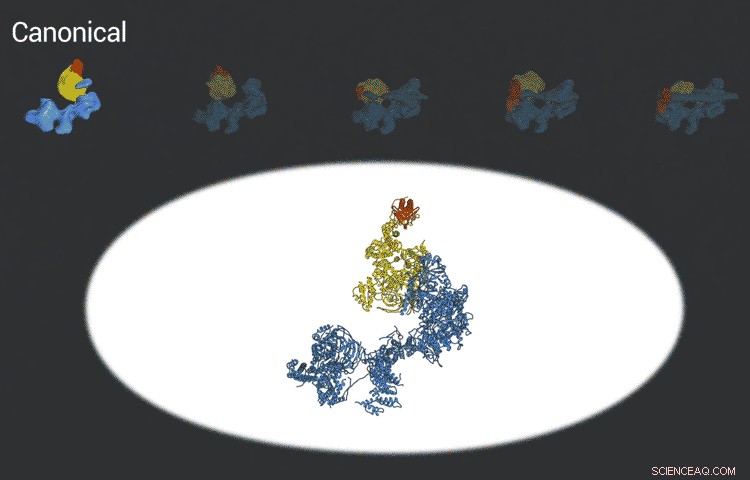
Het transcriptiefactor IID-complex vergrendelt op DNA, controleert of het op de juiste plaats zit en werft vervolgens andere eiwitten aan om te beginnen met het transcriberen van DNA in RNA. Dankzij nieuwe ontwikkelingen in cryo-EM konden onderzoekers vijf verschillende conformaties van TFIID definiëren terwijl het vergrendelt en laadt. Krediet:Eva Nogales-lab
De grenzen van cryo-elektronenmicroscopie verleggen, Universiteit van Californië, Berkeley, wetenschappers hebben stilstaande beelden vastgelegd van de veranderende vorm van een enorm molecuul, een van de belangrijkste moleculaire machines van het lichaam, omdat het zich vastzet op DNA en de machines laadt om de genetische code te lezen.
het molecuul, transcriptiefactor IID genoemd, is van cruciaal belang voor het transcriberen van genen in RNA dat later zal worden gebruikt als blauwdrukken om eiwitten te maken. Vanwege de vele bewegende delen en het grote formaat, echter, De 3D-structuur van TFIID is moeilijk vast te leggen:de bewegende delen worden wazig.
Cryo-EM, een beeldvormingstechniek waarvan de ontdekkers de Nobelprijs voor de Scheikunde 2017 wonnen, is de enige manier om een momentopname te krijgen van omvangrijke, floppy structuren zoals deze. Structurele informatie met een hoge resolutie is essentieel om te begrijpen hoe TFIID de bedieningsinstructies in ons genoom vertaalt en hoe het soms in de war raakt.
De nieuwe, meer gedetailleerde snapshots van de bewegende delen van het molecuul kunnen medicijnontwerpers helpen bij het maken van medicijnen die interfereren met de structurele veranderingen van het molecuul om de expressie van een gen dat ziekte veroorzaakt aan te passen.
"Deze structuren geven je de mogelijkheid om rationeel kleine moleculen te ontwerpen die de normale functie zullen verstoren, omdat we nu niet slechts één enkele structuur hebben, we hebben veel structuren, wat nog krachtiger is omdat we ons kunnen richten op de beweging die we nu zien, " zei Eva Nogales, een UC Berkeley hoogleraar moleculaire en celbiologie en een faculteitswetenschapper aan het Lawrence Berkeley National Laboratory.
Nogales en haar collega's, meest prominente UC Berkeley afgestudeerde studenten Avinash Patel en Robert Louder, plaatsten hun bevindingen deze week online voorafgaand aan de gedrukte publicatie in het tijdschrift Wetenschap .
"Waar je dat medicijn plakt en hoe je dat medicijn laat werken, is sterk afhankelijk van de voorbijgaande aard van deze structuren, en dat is iets wat we pas heel recent zijn gaan beseffen, " zei Robert Tjian, een professor in moleculaire en celbiologie aan de UC Berkeley die TFIID ontdekte en een groot deel van zijn carrière aan het molecuul heeft gewerkt, hoewel hij geen co-auteur van het nieuwe artikel was. "Omdat deze moleculen bewegen en hun structuren zo ingewikkeld zijn, conventionele medicijnontdekking zou nooit onthullen wat er aan de hand is. Eva's structuren gaan dat veranderen. Dit heeft het potentieel om het universum van medicamenteuze doelen te openen."
Bevriezing van moleculen
TFIID is een agglomeratie van meer dan een dozijn verschillende eiwitten die zich nestelen op een promotor - een DNA-gebied dat de transcriptie van een nabijgelegen gen regelt - en de sequentie test om er zeker van te zijn dat deze op de juiste plek is geland. Zodra dit is bevestigd, het opent om tientallen andere eiwitten te rekruteren die dan langs het gen beginnen te ratelen, de DNA-sequentie gebruiken als een sjabloon om een complementaire RNA-sequentie te creëren, boodschapper-RNA genoemd. Dit baant zich vervolgens een weg uit de kern naar het lichaam van de cel, waar het door andere moleculaire machines wordt vertaald in eiwit.
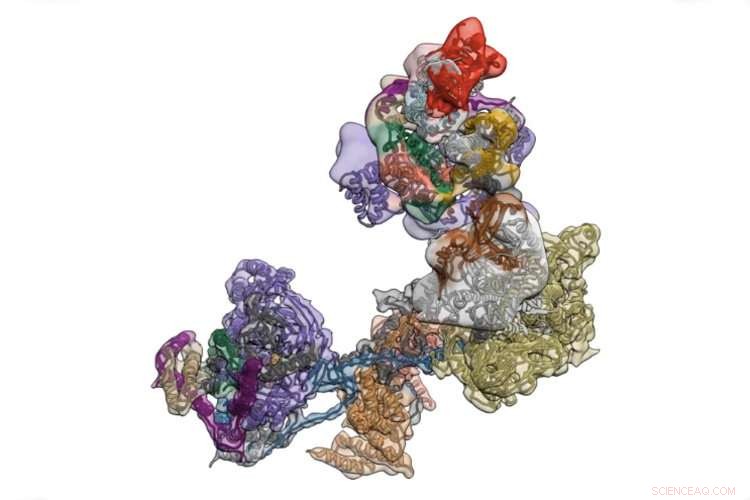
TFIID is een complex van eiwitten dat de transcriptie van de in het DNA gecodeerde bedieningsinstructies van het lichaam initieert. Krediet:Universiteit van Californië - Berkeley
"TFIID is waarschijnlijk de moeilijkste structuur die iemand heeft geprobeerd op te lossen, omdat het enorm en zeer flexibel is, "zei Tjian. "De enige manier waarop je deze zeer flexibele structuren kunt zien, is met cryo-EM, en Eva kan nu al deze verschillende flexibele toestanden bevriezen en de beweging beschrijven."
Cryo-EM omvat het bevriezen van een druppel die miljoenen kopieën van een molecuul bevat, in elke denkbare richting, en het gebruik van een elektronenmicroscoop om de structuur te bepalen door afbeeldingen te combineren om de 3D-vorm te definiëren. Omdat TFIID veel bewegende delen heeft omdat het zich bindt aan DNA en klaar is om een gen te transcriberen, het middelen van alle bevroren posities levert een wazig beeld op.
Nogales vergelijkt eerdere inspanningen bij het afbeelden van TFIID, inclusief haar eigen pogingen die bijna 20 jaar teruggaan, tot het maken van een foto van een voetbalteam op het veld en het middelen van de bewegingen van alle spelers. Het resultaat is een generieke menselijke torso met wazig hoofd en ledematen.
Het voetbalveld in beeld brengen
Nutsvoorzieningen, dankzij meer dan twee jaar intensief werk door Patel en Louder, het is mogelijk om beelden met een hogere resolutie vast te leggen die vergelijkbaar zijn met het onderscheiden van een trap van een aanvaller uit een handblok van een keeper en een kopbal van een vleugelverdediger.
"Stel je hebt een beeld van de 22 voetballers op het veld, en je zou ze combineren tot een enkele eenheid die je de 'generieke voetballer, '" zei ze. "Het ziet eruit als een wazige foto - je zou nauwelijks kunnen zien dat het een mensachtige vorm is en dat er een soort beweging is, maar je zou niet beseffen dat er een verschil bestaat tussen de spelers."
The improved pictures are a result of better detectors developed originally by colleagues at Berkeley Lab, and steadily improving computer algorithms to analyze the huge amounts of data collected by the detectors. This helped Nogales and her team to define five distinct structures of the TFIID molecule.
"They span the whole binding sequence:before binding to the DNA, initial binding to the promoter, subsequent binding after it double checks that this is the right place, and the final state, " Nogales said.
She and her colleagues continue to push the limits of cryo-EM, hoping to determine the 3-D structure of TFIID after other transcription proteins land on it to complete the transcription process.
 Er komt meer plastic aan:wat het betekent voor klimaatverandering
Er komt meer plastic aan:wat het betekent voor klimaatverandering The Migration of Hummingbirds to South Florida
The Migration of Hummingbirds to South Florida  Recorddroogte verhoogt de angst voor droogte in Californië
Recorddroogte verhoogt de angst voor droogte in Californië Klein lek gevonden van nucleaire Sovjet-onderzeeër die in 1989 zonk
Klein lek gevonden van nucleaire Sovjet-onderzeeër die in 1989 zonk Te nat? Te koud? Te heet? Zo beïnvloedt het weer de reizen die we maken
Te nat? Te koud? Te heet? Zo beïnvloedt het weer de reizen die we maken
Hoofdlijnen
- Unieke manieren om een DNA-model te bouwen
- Plantenziekte bestrijden bij warme temperaturen houdt voedsel op tafel
- Ademhaling bij planten en dieren
- Triest afscheid als de in Maleisië geboren panda naar China gaat
- Hoe slapende listeria zich in cellen verbergt
- Brandstof voor de toekomst:wetenschappers promoten nieuwe methode voor de productie van algenwaterstof
- Wanneer gebeurt er wanneer mitose verkeerd gaat en in welke fase zal het verkeerd gaan?
- Mot bleek verschillende verdedigingsvloeistoffen af te scheiden om verschillende soorten roofdieren af te weren
- De productie van recombinante menselijke groeihormonen door Recombinant DNA Technology
- "IB Group 4 Project Ideas

- Single-particle spectroscopie van CsPbBr3-perovskiet onthult de oorsprong van lage elektrolumine

- Microstaafjes gemaakt van lanthanoïde organische raamwerken fungeren als optische golfgeleiders op microschaal

- Een nieuw materiaal voor de batterij van de toekomst

- Waterstofproductie in een besloten ruimte
 Microweefsel kweken ter vervanging van dierproeven
Microweefsel kweken ter vervanging van dierproeven Opvouwbare op silicium gebaseerde elektronica lost kwetsbaarheidsprobleem op
Opvouwbare op silicium gebaseerde elektronica lost kwetsbaarheidsprobleem op Hoe NORAD werkt
Hoe NORAD werkt  Een taps toelopend siliciumgat kan leiden tot betere medicijntesten
Een taps toelopend siliciumgat kan leiden tot betere medicijntesten Niet-ontvlambaar grafeenmembraan ontwikkeld voor veilige massaproductie
Niet-ontvlambaar grafeenmembraan ontwikkeld voor veilige massaproductie Onderzoekers kraken mengsels van oplosmiddelen puzzel
Onderzoekers kraken mengsels van oplosmiddelen puzzel Wanneer is Amazon Prime Day? De date is uit - en het is net om de hoek
Wanneer is Amazon Prime Day? De date is uit - en het is net om de hoek Symbiotisch plankton:leveranciers of parasieten?
Symbiotisch plankton:leveranciers of parasieten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

