
Wetenschap
Het volgen van eiwitverwijdering kan leiden tot verbeterde therapieën

Hiroaki Kiyokawa, MD, doctoraat, hoogleraar Farmacologie en Pathologie, was co-senior auteur van studies gepubliceerd in Natuurcommunicatie en wetenschappelijke vooruitgang . Krediet:Northwestern University
Onderzoekers van de Northwestern Medicine ontwikkelden een techniek om te catalogiseren hoe cellen zich ontdoen van onnodige eiwitten, een proces dat gevolgen heeft voor kanker en autismespectrumziekten, volgens bevindingen gepubliceerd in Natuurcommunicatie .
Defecten in ubiquitinatie, of hoe cellen zich ontdoen van onnodige eiwitten, betrokken zijn bij verschillende ziekten, maar het ontbrak wetenschappers eerder aan een betrouwbare methode om de enzymen te volgen die betrokken zijn bij dit verwijderingsproces, volgens Hiroaki Kiyokawa, MD, doctoraat, hoogleraar farmacologie en co-senior auteur van het onderzoek.
Om dit tegen te gaan, een samenwerkend team onder leiding van Kiyokawa en Jun Yin, doctoraat, universitair hoofddocent scheikunde aan de Georgia State University, ontwikkelde orthogonale ubiquitine-overdracht, een methode om bij te houden welke enzymen de verwijdering van welke eiwitten veroorzaken. Deze techniek kan wetenschappers een beter begrip geven van de mechanismen van ziekte die voortkomt uit abnormale ubiquitinatie, hopelijk leidend tot verbeterde therapie, zei Kiyokawa.
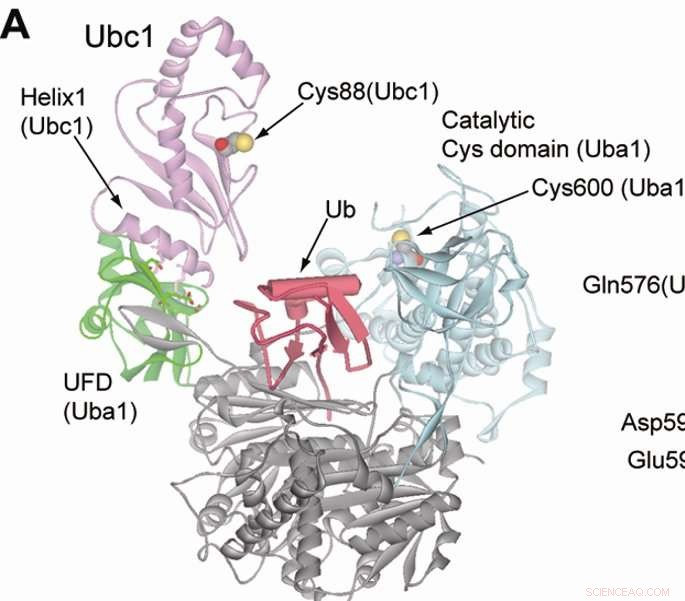
Ubiquitinatie markeert eiwitten voor vernietiging en wordt mogelijk gemaakt door drie klassen enzymen; E1, E2- en E3-enzymen. Ubiquitine is op volgorde gebonden aan de drie enzymen, maar E1- en E2-enzymen zijn eenvoudige primer-enzymen, dus zoogdiercellen hebben slechts een beperkt aantal E1- en E2-variëteiten. Anderzijds, er zijn honderden E3-enzymen, wat suggereert dat elke E3 zijn eigen unieke eiwitdoelwit heeft.
"De relatie tussen E3-enzymen en het doeleiwit is als een slot en een sleutel, " zei Kiyokawa, ook een professor in Pathologie en een lid van de Robert. H. Lurie Comprehensive Cancer Center van de Northwestern University.
Door de diversiteit van doeleiwitten en zwakke interacties kan het een uitdaging zijn om duidelijk te identificeren welk E3-enzym welk eiwit tagt. Echter, orthogonale ubiquitine-overdracht (OUT) is een nieuwe oplossing voor het probleem, volgens Kiyokawa.
In uit, wetenschappers hebben een kunstmatige ubiquitine-route ontwikkeld die het oorspronkelijke systeem nabootst, maar alleen reageert op gemuteerd ubiquitine, die een speciale tag heeft waarmee wetenschappers het eiwit kunnen identificeren waarop het zich uiteindelijk richt aan het einde van de cyclus.
"Er zijn twee paden binnen dezelfde cellen, " zei Kiyokawa. "Het origineel is als een snelweg, en het aangelegde pad is een omweg."
Illustratie die laat zien dat ubiquitine van een El-enzym naar een E2-enzym gaat. Krediet:Northwestern University
In de huidige studie, de onderzoekers construeerden een kunstmatige route voor een E3-enzym genaamd E6AP, en introduceerde de gemuteerde ubiquitine en routes in cellen. Na een proteomics-scherm, de wetenschappers waren in staat om de specifieke eiwitdoelen van E6AP te identificeren.
"Deze studie is slechts een showcase van de technologie, maar we denken dat we dit zonder al te veel gedoe op veel van de 600 E3-eiwitten kunnen toepassen, "Zei Kiyokawa. "Van nogal wat E3-enzymen is bekend dat ze tot overexpressie worden gebracht of gemuteerd bij neuronale ziekten, dus er is een grote pool aan onderzoeksmogelijkheden."
Echter, Van E6AP in het bijzonder is aangetoond dat het zich richt op tumorsuppressor-eiwitten wanneer het onjuist wordt geactiveerd door het humaan papillomavirus, bijdragen aan het verhoogde risico op kanker waarmee geïnfecteerde patiënten worden geconfronteerd. In aanvulling, het is bekend dat de genlocus die codeert voor E6AP gemuteerd is bij het Angelman-syndroom, een autismespectrumstoornis.
"We weten nog steeds niet waarom E6AP moet worden gemuteerd om symptomen van het Angelman-syndroom te vertonen, maar onderzoek naar specifieke doelwitten kan ons meer leren over de pathofysiologische mechanismen van autistische ziekten, ' zei Kiyokawa.
Verder onderzoek naar specifieke doelen is al aan de gang - Kiyokawa en collega's hebben onlangs een ander onderzoek gepubliceerd met OUT, deze keer binnen wetenschappelijke vooruitgang .
Ze vonden een ander E3-enzym, CHIP, was betrokken bij de afbraak van CDK4, een enzym dat een sleutelrol speelt bij celproliferatie.
"Het lijkt een mechanisme te zijn dat de celcyclus onder stress kan stoppen, " zei Kiyokawa. "Als deze verordening wordt overtreden, het organisme kan vatbaarder zijn voor kanker."
Nog, het is niet genoeg om deze doelen van alomtegenwoordigheid te identificeren, volgens Kiyokawa.
"We moeten leren waarom deze nieuw gedefinieerde doelen onder de regulering van E3-enzymen vallen als we nieuwe therapeutische doelen willen vinden, " zei hij. "Alleen dan kunnen we medicijnen of behandelingen ontwikkelen."
 Land dat 2,4 miljard jaar geleden boven de zee uitstak, veranderde planeet Aarde
Land dat 2,4 miljard jaar geleden boven de zee uitstak, veranderde planeet Aarde Hoe invasieve uitwerpselen van regenwormen de Amerikaanse bodem veranderen?
Hoe invasieve uitwerpselen van regenwormen de Amerikaanse bodem veranderen? Bijwerkingen Cetylpyridiniumchloride
Bijwerkingen Cetylpyridiniumchloride Het probleem van plasticvervuiling kan grotere gevolgen hebben dan we denken
Het probleem van plasticvervuiling kan grotere gevolgen hebben dan we denken Gerecycleerde elektrische producten leiden tot gevaarlijke chemicaliën in alledaagse voorwerpen
Gerecycleerde elektrische producten leiden tot gevaarlijke chemicaliën in alledaagse voorwerpen
Hoofdlijnen
- Wat zijn twee kenmerken van mRNA in eukaryoten?
- Kijk hoe bacteriën muteren tot medicijnresistente superbacteriën
- Wetenschapsproject over waarom botten rubberachtig worden in azijn
- Habitatverlies is de grootste bedreiging voor Australische soorten
- Hoe te lezen Proteïne elektroforese
- Industrieel gebruik van Pepsin
- 'S Werelds kleinste bandrecorder is gemaakt van microben
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Overeenkomsten van de mitochondria en nucleus
- Mysterie van hoe zwarte weduwe-spinnen ijzersterke zijden webben creëren, verder ontrafeld

- Robuuste en goedkope katalysatoren voor waterstofproductie

- Een beter polyethyleen bouwen
- Een betere zoutvanger bouwen:wetenschappers synthetiseren een moleculaire kooi om chloride op te vangen
- Video:Gallium en de geschiedenis van het periodiek systeem

 Stofstormen wervelen rond de noordpool van Mars
Stofstormen wervelen rond de noordpool van Mars Onderzoekers werpen licht op de evolutie van extremistische groepen
Onderzoekers werpen licht op de evolutie van extremistische groepen Hoe u een percentage van de maandelijkse groei berekent
Hoe u een percentage van de maandelijkse groei berekent Onderzoekers maken solide basis voor betere lithium-ionbatterij-interfaces
Onderzoekers maken solide basis voor betere lithium-ionbatterij-interfaces Wat gebeurt er tijdens de G1-fase?
Wat gebeurt er tijdens de G1-fase?  Hoe werkt een waterstofgenerator?
Hoe werkt een waterstofgenerator?  Antibioticaresistente genen in de lucht onder de loep
Antibioticaresistente genen in de lucht onder de loep NASA moedigt kinderen aan om te trainen als een astronaut
NASA moedigt kinderen aan om te trainen als een astronaut
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

