Wetenschap
Het Bohr-model:snel vervangen maar nooit vergeten
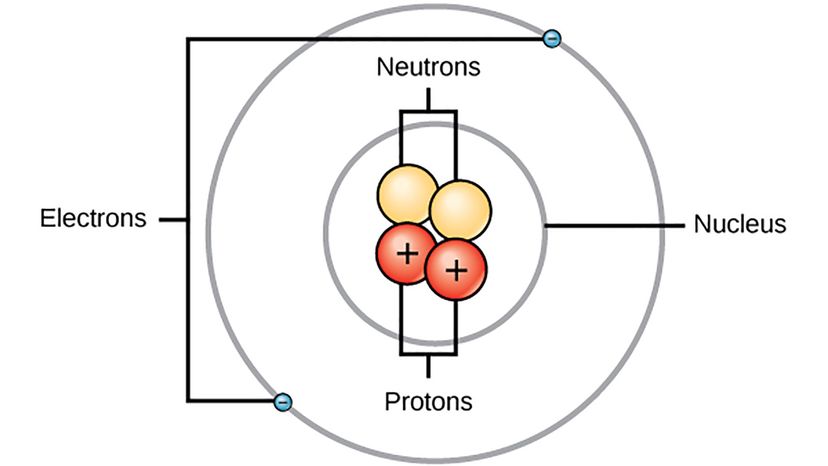
Je kunt op internet zoeken naar een afbeelding van een atoom en je zult er een vinden, ook al heeft niemand ooit een atoom gezien. Maar we hebben een schatting van hoe een enkel atoom eruitziet vanwege het werk van een aantal verschillende wetenschappers, zoals de Deense natuurkundige Niels Bohr.
Atomen zijn de bouwstenen van materie - een enkel atoom van elk afzonderlijk element is de meest elementaire entiteit in de natuur die zich nog steeds houdt aan de natuurkundige regels die we in het dagelijks leven kunnen waarnemen (de subatomaire deeltjes waaruit atomen bestaan, hebben hun eigen speciale regels) . Wetenschappers vermoedden dat atomen al lang bestonden voordat ze hun structuur konden conceptualiseren - zelfs de oude Grieken dachten dat de materie van het universum bestond uit componenten die zo klein waren dat ze niet konden worden afgebroken tot iets kleiners, en ze noemden deze fundamentele eenheden atomen , wat 'onverdeeld' betekent. Tegen het einde van de 19e eeuw, men begreep dat chemische stoffen konden worden afgebroken tot atomen, die erg klein waren en atomen van verschillende elementen een voorspelbaar gewicht hadden.
Maar dan, in 1897, Britse natuurkundige J.J. Thomson ontdekte elektronen - negatief geladen deeltjes in de atomen waarvan iedereen het grootste deel van een eeuw had gedacht dat ze volledig ondeelbaar waren - als de kleinste dingen die bestonden. Thomson veronderstelde net dat elektronen bestonden, maar hij kon niet precies achterhalen hoe elektronen in een atoom passen. Zijn beste gok was het "pruimenpuddingmodel, " die het atoom afbeeldde als een positief geladen taart bezaaid met negatief geladen gebieden die overal verspreid zijn, zoals fruit in een ouderwets dessert.
"Elektronen bleken negatief elektrisch te zijn, en allemaal met dezelfde massa en heel klein vergeleken met atomen, " zegt Dudley Herschbach, een scheikundige van Harvard die in 1986 de Nobelprijs voor Scheikunde deelde voor zijn "bijdragen aan de dynamiek van chemische elementaire processen, " in een e-mail. "Ernest Rutherford ontdekte de kern in 1911. Kernen waren positief elektrisch, met verschillende massa's maar veel groter dan elektronen, maar erg klein van formaat."
Een gigantische sprong voorwaarts
Niels Bohr was de student van Rutherford die in 1912 het project van zijn mentor om de structuur van het atoom te ontcijferen op een moedige manier overnam. Het kostte hem slechts een jaar om met een werkend model van een waterstofatoom te komen.
"Bohr's model van 1913 voor het waterstofatoom had cirkelvormige elektronenbanen rond het proton - zoals de aarde rond de zon draait, " zegt Herschbach. "Bohr had gebruik gemaakt van een eenvoudig en regelmatig patroon voor het spectrum van het waterstofatoom, die in 1885 door Johann Balmer was gevonden. Hij maakte ook gebruik van het idee van het kwantumidee, gevonden door Max Planck in 1900."
1913, Het Bohr-model was een enorme sprong voorwaarts omdat het kenmerken van de pasgeboren kwantummechanica in de beschrijving van atomen en moleculen verwerkte. Dat jaar, hij publiceerde drie artikelen over de samenstelling van atomen en moleculen:de eerste en meest bekende was gewijd aan het waterstofatoom en de andere twee beschreven enkele elementen met meer elektronen, zijn model als kader gebruiken. Het model dat hij voorstelde voor het waterstofatoom liet elektronen rond de kern bewegen, maar alleen op speciale tracks met verschillende energieniveaus. Bohr veronderstelde dat licht werd uitgestraald wanneer een elektron van een hogere energiebaan naar een lagere energiebaan sprong - dat is wat waterstof in een glazen buis deed gloeien. Hij heeft waterstof goed, maar zijn model was een beetje glitchy.
"Het model kon de juiste waarde van de grondtoestandsenergieën van veel-elektronatomen en bindingsenergieën van de moleculen niet voorspellen - zelfs voor de eenvoudigste 2-elektronsystemen, zoals het heliumatoom of een waterstofmolecuul, " zegt Anatoly Svidzinsky, een professor aan het Institute for Quantum Science and Engineering in Texas A&M, in een e-mailgesprek. "Dus, al in 1913, het was duidelijk dat het model van Bohr niet helemaal correct is. Zelfs voor het waterstofatoom, het Bohr-model voorspelt ten onrechte dat de grondtoestand van het atoom een baanimpulsmoment heeft dat niet gelijk is aan nul."
De 1922 Nobelprijs
Die, natuurlijk, misschien niet zo logisch voor je als je geen kwantumfysicus bent. Echter, Het model van Bohr was versneld om in 1922 een Nobelprijs voor natuurkunde te ontvangen. Maar terwijl Bohr zijn reputatie in de wereld van de natuurkunde aan het versterken was, wetenschappers verbeterden zijn model:
"Bohr's model voor het waterstofatoom werd in 1916 verbeterd door Arnold Sommerfeld, ", zegt Herschbach. "Hij vond elliptische banen die verantwoordelijk waren voor spectralijnen in de buurt van die uit cirkelvormige banen. Het Bohr-Sommerfeld-model voor het waterstofatoom is eenvoudig, maar kwantum en relativiteit werden belangrijke aspecten."
Tussen 1925 en 1928, Werner Heisenberg, Max geboren, Wolfgang Pauli, Erwin Schrodinger en Paul Dirac ontwikkelden deze aspecten tot ver buiten het atoommodel van Bohr, maar hij is verreweg het meest erkende model van een atoom. De atoommodellen die de kwantumfysica ons heeft gegeven, lijken minder op een zon omringd door elektronenplaneten en meer op moderne kunst. Waarschijnlijk gebruiken we nog steeds het Bohr-model omdat het een goede introductie is tot het concept van een atoom.
"In 1913, Het model van Bohr toonde aan dat kwantisatie de juiste weg is in de beschrijving van de microwereld, " zegt Svidzinsky. "Dus, Het model van Bohr toonde wetenschappers een richting om te zoeken en stimuleerde de verdere ontwikkeling van de kwantummechanica. Als je de weg kent, dan vindt u vroeg of laat de juiste oplossing voor het probleem. Je kunt het Bohr-model zien als een van de richtingborden langs een wandelpad naar de kwantumwereld."
Dat is nu interessantNiels Bohrs vader, Christian Bohr, werd genomineerd voor drie verschillende Nobelprijzen voor de Fysiologie van de Geneeskunde, hoewel hij nooit won.
Hoofdlijnen
- Wat zijn de niveaus van organisatie in de biologie?
- Wat zijn fysieke kenmerken die worden doorgegeven van ouders?
- Typen biologie-experimenten
- Hoe duplicaten in twee rijen in OpenOffice te verwijderen
- Vijf soorten isolatie in de biologie
- Verschillen tussen "Fysiek" en "Fysiologisch"
- Adenosine trifosfaat (ATP): definitie, structuur en functie
- Instrumenten gebruikt in de biologie
Biologen en biologiestudenten gebruiken verschillende instrumenten in hun werk om kennis over levende wezens te verzamelen. Deze instrumenten en hulpmiddelen worden elk jaar gedetailleerder en hightech, evenals
- Wat is het Human Epigenome Project?
 Wat is het verschil tussen kwarts en bergkristal?
Wat is het verschil tussen kwarts en bergkristal?  Hoe kunnen astronomen vertellen wat een verre objecttemperatuur is?
Hoe kunnen astronomen vertellen wat een verre objecttemperatuur is?  Reproductie en ontwikkeling van dieren
Reproductie en ontwikkeling van dieren  Berekening van de batterij Watt-uren
Berekening van de batterij Watt-uren Hoe isotopen te vinden
Hoe isotopen te vinden Hoe beïnvloeden grote wateren het klimaat van de kustgebieden?
Hoe beïnvloeden grote wateren het klimaat van de kustgebieden?  Wat zijn de voordelen van uraniumwinning?
Wat zijn de voordelen van uraniumwinning?  Wat is osmolariteit?
Wat is osmolariteit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com