
Wetenschap
Een nieuwe coatingmethode in mRNA-engineering wijst de weg naar geavanceerde therapieën
Medicijnen kunnen bepaalde ziekten helpen behandelen; Antibiotica kunnen bijvoorbeeld infecties helpen overwinnen, maar een nieuw, veelbelovend gebied van de geneeskunde houdt in dat we ons lichaam de 'blauwdruk' geven waarmee we zelf ziekten kunnen verslaan.
mRNA-therapie is de levering van boodschapper-RNA (mRNA)-moleculen in het lichaam, die de cellulaire machinerie kan gebruiken om specifieke eiwitten te maken. Het veld ontwikkelt zich snel, vooral omdat mRNA-vaccins succesvol zijn gebleken tegen COVID-19. De levering van deze gemanipuleerde mRNA's aan een specifiek orgaan is echter een uitdaging gebleken.
Nu heeft een team van de Tokyo Medical and Dental University (TMDU) aangetoond dat het coaten van de gemanipuleerde mRNA's met een molecuul genaamd polyethyleenglycol, of PEG, hun selectieve afgifte aan de milt mogelijk maakt. Het onderzoek is gepubliceerd in het tijdschrift Small Science .
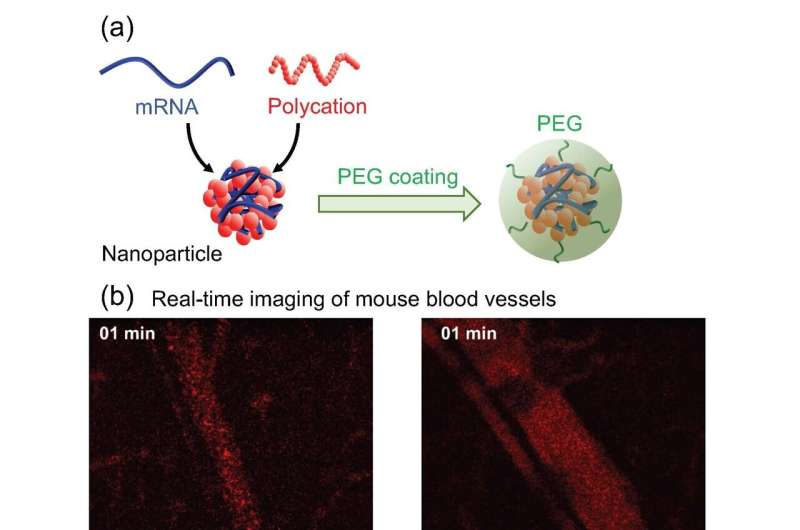
Gemanipuleerde mRNA's zijn verpakt in structuren die polyplexen worden genoemd en die in het lichaam worden afgeleverd. De polyplexstructuren zorgen ervoor dat mRNA's stabiel blijven buiten de cellen en op een gecontroleerde manier worden vrijgegeven zodra ze zich in de cellen bevinden. Eenmaal binnen worden de mRNA's door cellulaire machines gebruikt om eiwitten te produceren die van nature disfunctioneel of afwezig zijn.
Zonder wijziging hebben de polyplexen de neiging zich op te hopen in de longen, omdat ze na injectie in het bloed snel aan elkaar en aan de omliggende eiwitten en cellen blijven kleven en vast komen te zitten in de bloedvaten van de longen. Het behandelen van polyplexen met PEG, een proces dat 'PEGylatie' wordt genoemd, voorkomt dat ze aan elkaar blijven kleven; het aanbrengen van PEG op een gecontroleerde, consistente manier op het polyplexoppervlak is echter erg moeilijk.
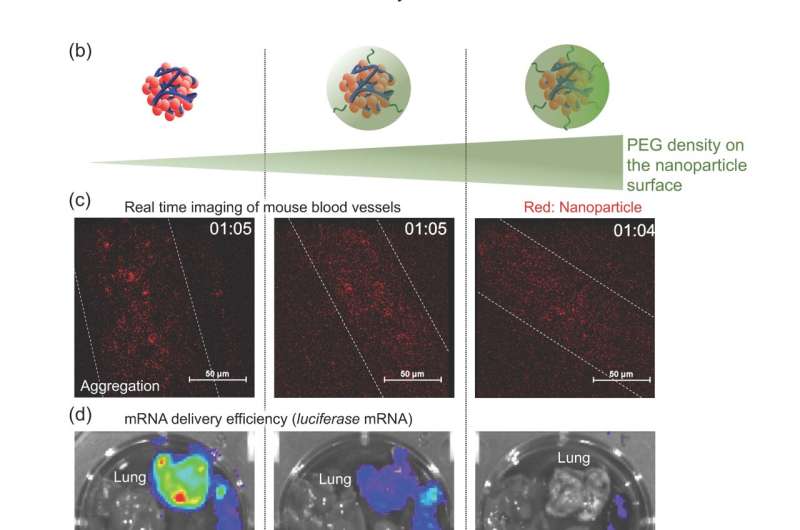
Het team van TMDU heeft een nieuwe methode voor PEGylatie ontwikkeld, waarbij de mRNA's worden gehybridiseerd met PEG-moleculen voordat de polyplexen worden gevormd. Met behulp van deze methode worden bijna alle PEG-strengen die in de reactie worden gemengd, gebonden aan de polyplexen, waardoor een veel grotere controle over de uiteindelijke hoeveelheid PEG op het polyplexoppervlak mogelijk wordt.
Met behulp van een muismodel ontdekte het team dat de hoeveelheden en lengtes van de PEG-moleculen een significante invloed hadden op hoe goed de mRNA-therapie werkte. Een klein aantal korte PEG-moleculen verhinderde de accumulatie van de gemanipuleerde mRNA's in de longen, waardoor een effectieve afgifte aan de milt werd vergemakkelijkt. Deze aanpak heeft zijn nut in mRNA-vaccins aangetoond.
"Onze nieuwe methode maakt het mogelijk om de hoeveelheid PEGylatie van mRNA-polyplexen te verfijnen", legt senior auteur Dr. Satoshi Uchida uit, "wat op zijn beurt controle mogelijk maakt over de fysisch-chemische eigenschappen van de polyplexen, en dus over hun biologische functionaliteiten."
mRNA-technologie heeft een breed potentieel voor de behandeling van vele ziekten die voorheen als ongeneeslijk werden beschouwd, evenals voor de ontwikkeling van nieuwe kankerbehandelingen en vaccins. De ontwikkeling van deze innovatieve techniek maakt de weg vrij voor aanzienlijke vooruitgang in het therapeutische gebruik van mRNA-polyplexen, met verstrekkende potentiële gevolgen voor de menselijke gezondheid.