
Wetenschap
Onderzoekers creëren nanomembraan om de reactiesnelheid bij de chemische productie te verhogen
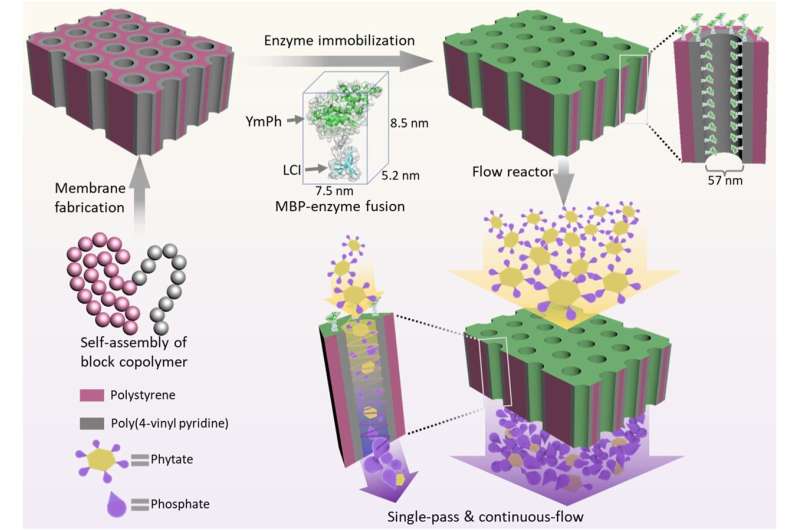
Doorstroomreactoren boordevol enzymen kunnen op een zachte en zorgvuldige manier bepaalde chemicaliën produceren. Hun prestaties zijn tot nu toe echter beperkt gebleven. Een onderzoeksteam van het Helmholtz-Zentrum Hereon en de RWTH Universiteit van Aken heeft de opbrengst nu verduizendvoudigd.
Met behulp van een op maat gemaakt nanomembraan zijn ze erin geslaagd de om te zetten moleculen veel nauwer in contact te brengen met de enzymen, waardoor de reactiesnelheid dramatisch toeneemt. Het nieuwe proces zou onder meer ingezet kunnen worden voor de duurzame productie van fosfaat. De werkgroep presenteert haar resultaten in het tijdschrift Nature Communications .
Enzymen zijn biokatalysatoren waarmee op een milieuvriendelijke en energiebesparende manier chemicaliën kunnen worden geproduceerd. Het proces maakt het echter niet altijd gemakkelijk om ze efficiënt te gebruiken. Eén van de concepten zijn doorstroomreactoren. Ze bestaan uit kleine kanaaltjes waaraan de enzymen zich hechten. Wanneer een oplossing door deze kanalen stroomt, kunnen de moleculen in de oplossing zich aan de biokatalysatoren hechten om met hun hulp te reageren en het gewenste product te vormen.
Tot nu toe hebben deze reactoren niet optimaal gewerkt, omdat ze meestal kanalen van millimeterformaat hebben; de enzymen daarentegen zijn van nanometerformaat. Hierdoor komen veel van de doorstromende moleculen niet eens in contact met de biokatalysatoren en krijgen daardoor geen kans op een chemische reactie.
Schokdemper voor enzymen
Om dit probleem op te lossen gebruikte de werkgroep een speciaal membraan ontwikkeld in het Helmholtz-Zentrum Hereon in Geesthacht. "Dit membraan ontstaat door de zelfassemblage van zogenaamde blokcopolymeren", legt dr. Volker Abetz uit, hoofd van het Hereon Institute of Membrane Research en hoogleraar fysische chemie aan de Universiteit van Hamburg. "Hun oppervlak heeft een hoge dichtheid van cilindrische poriën van gelijke grootte." Deze zijn klein, met een diameter van slechts 50 nanometer. Onder het oppervlak bevindt zich een meer open, poreuze structuur gemaakt van hetzelfde blokcopolymeer.
De wetenschappers gebruikten een speciaal ontworpen hulpmolecuul – een soort adhesief peptide – om deze poriewanden te voorzien van enzymen. "Het bindt zich met de ene kant aan de poriewand en met de andere kant aan het enzym", legt Dr. Ulrich Schwaneberg uit, hoogleraar biotechnologie aan de RWTH Universiteit van Aken en lid van het wetenschappelijk management van het Leibniz Instituut voor Interactieve Materialen. "Het peptide fungeert als een soort schokdemper die het enzym te allen tijde op een bepaalde afstand van de poriewand houdt."
Het team gebruikte voor hun prototype een enzym genaamd fytase. Het zorgt voor de afbraak van fytaat, een fosforhoudende verbinding die onder meer in granen voorkomt. In de praktijk wordt het fytase-enzym aan bijvoorbeeld veevoer toegevoegd. Dit bevordert de afgifte van biogeen fosfaat, dat vervolgens kan worden gebruikt als duurzame meststof.
Succesvolle duurtest
“Het prototype van onze stromingsreactor heeft een relatief eenvoudig ontwerp”, zegt Hereon-onderzoeker dr. Zhenzhen Zhang. "Het membraan heeft ongeveer de grootte van een vel papier, plus een systeem dat ervoor zorgt dat de fytaatoplossing door het membraan kan stromen."
Als gevolg hiervan konden, dankzij de nauwe poriën die dicht opeengepakt waren met enzymen, ongeveer duizend keer meer fytaatmoleculen in fosfaat worden omgezet dan in de voorgaande doorstroomreactoren – een opmerkelijke opbrengst. Het was ook nuttig dat de membraanporiën elektrisch positief geladen waren en de fytaatmoleculen negatief geladen. De resulterende aantrekkingskrachten hielpen ook om de moleculen in contact te brengen met de enzymen.
"We hebben het membraan 30 dagen getest en het verloor heel weinig aan efficiëntie", zegt Zhang. “Het moet zeker mogelijk zijn om onze reactor op te schalen naar industriële schaal.” Omdat het Hereon-proces ook gebruikt kan worden om membranen met kleinere of grotere poriën te produceren, zou het ook mogelijk moeten zijn om de reactor uit te rusten met andere enzymen die vervolgens andere chemische reacties kunnen versnellen.
Er zijn echter nog steeds onbeantwoorde vragen die moeten worden opgehelderd. "We hebben nog niet in detail begrepen hoe de membraanstructuren worden gevormd", legt Abetz uit. "Als het ons lukt, hopen we de cilindrische poriën in het membraan veel gerichter te kunnen produceren dan voorheen."