
Wetenschap
Op ferritine gebaseerde nanogeneeskunde ontwikkeld voor gerichte leukemietherapie
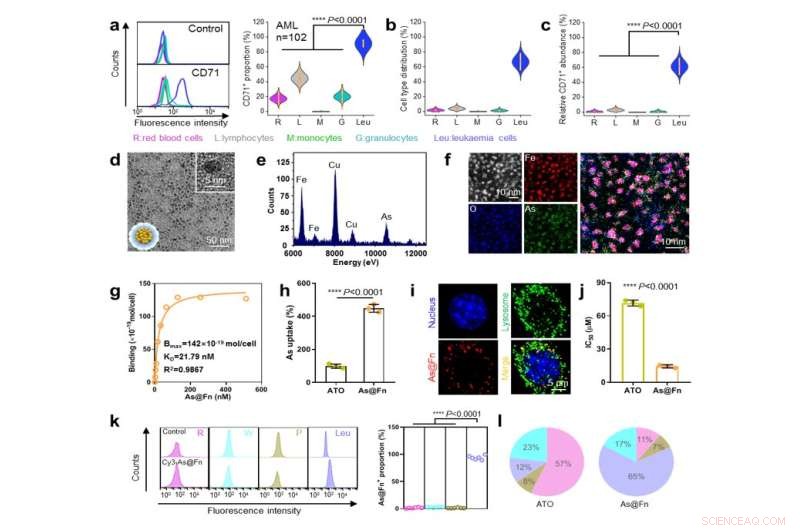
CD71-expressie op leukemiecellen, As@Fn-constructie en analyse van het targetingvermogen. Krediet:IPE
Onderzoekers van het Institute of Process Engineering (IPE) van de Chinese Academie van Wetenschappen, de Universiteit van Peking en het Zhujiang-ziekenhuis van de Southern Medical University hebben een op ferritine (Fn) gebaseerd nanomedicijn ontwikkeld voor gerichte toediening van arseen (As) en efficiënte therapie tegen diverse leukemie soorten.
De studie werd gepubliceerd in Nature Nanotechnology op 25 oktober.
Leukemie is een ernstige bedreiging voor de menselijke gezondheid, met slechte overlevingskansen voor zowel volwassenen als kinderen. In de kliniek is chemotherapie nog steeds de belangrijkste therapeutische modaliteit voor alle soorten leukemie en leidt onvermijdelijk tot verspreiding buiten het doelwit en toxische bijwerkingen.
Gerichte afgifte van chemotherapeutische geneesmiddelen aan leukemiecellen kan toxische bijwerkingen verlichten en therapeutische effecten versterken. Er zijn verschillende nieuwe doelwitten geïdentificeerd op leukemiecellen, maar hun expressiekenmerken variëren sterk voor verschillende soorten en cursussen van leukemie.
Door grote aantallen klinische monsters te screenen, bevestigden onderzoekers dat patiënten met verschillende vormen van leukemie een stabiele en sterke expressie van CD71 vertoonden. "CD71 kan worden gebruikt als een nieuw en betrouwbaar doelwit voor de ontwikkeling van precisietherapieën tegen leukemie", zegt prof. Li Yuhua van het Zhujiang-ziekenhuis.
Als CD71-ligand heeft Fn een unieke quaternaire structuur en inwendige holte, die gunstig zijn voor de accommodatie van geneesmiddelen. Met behulp van een door ijzer gemedieerd coördinatieproces werd trivalent As (AsIII), de medicinale vorm van het chemotherapeutische geneesmiddel arseentrioxide (ATO), efficiënt in Fn geladen.
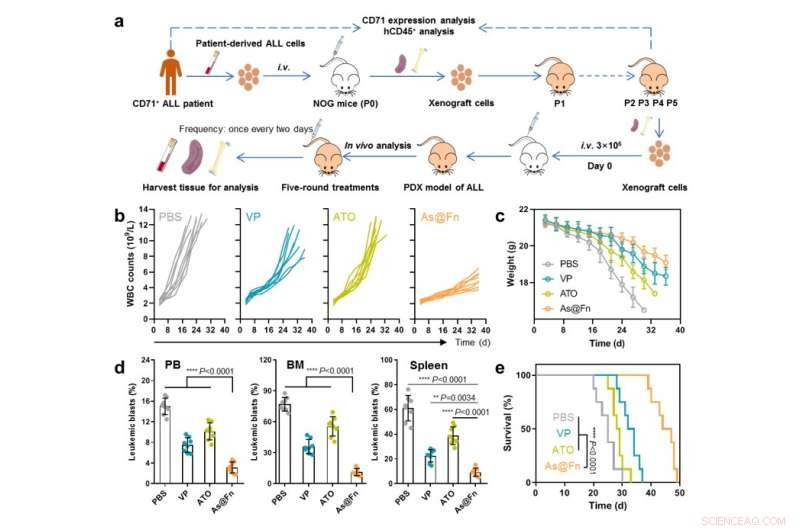
Krachtige anti-leukemie-activiteit van As@Fn in van een patiënt afgeleid xenotransplantaatmodel. Krediet:IPE
"De laadinhoud is ~200 As in elke Fn en de As komt overeen met de bekende klinisch effectieve valentiestatus van de goedgekeurde ATO", zegt prof. Ma Ding van de Universiteit van Peking.
De As@Fn-formulering behield een sterk vermogen om te binden aan verschillende soorten leukemiecellen. Na internalisatie zou de AsIII dan worden vrijgegeven in het zure lysosoom.
"We zijn verheugd om te zien dat onze As@Fn-nanomedicine de As-accumulatie in leukemiecellen zowel in vitro als in vivo aanzienlijk heeft verbeterd", zegt prof. Wei Wei van IPE. "Dergelijk doelwitgedrag is gunstig voor het verbeteren van het dodende effect op leukemiecellen terwijl de toxiciteit voor normale weefsels wordt verminderd."
In termen van therapeutische werkzaamheid presteerde As@Fn beter dan de gouden standaard in diverse van cellijn afgeleide xenograft-modellen, evenals in een patiënt-afgeleide xenograft-model.
"Dit nanomedicijn breidde niet alleen het therapeutische venster van As uit, maar breidde de toepassing ook uit naar meer soorten leukemie", zegt prof. Ma Guanghui van IPE. "Aangezien Fn een endogeen eiwit is en ATO is goedgekeurd voor klinisch gebruik tegen leukemie, heeft onze nanogeneeskunde het potentieel voor klinische vertaling."
Een peer reviewer van Nature Nanotechnology zei:"Over het algemeen was de studie goed uitgevoerd en gecontroleerd met een aanzienlijke hoeveelheid in vitro en in vivo gegevens om te ondersteunen dat de nieuw ontwikkelde As@Fn als een nieuw op ferritine gebaseerd As-nanomedicijn effectief is om diverse menselijke leukemie te behandelen." + Verder verkennen
Wetenschappers ontwikkelen nieuw nauwkeurig therapeutisch leukemievaccin
 Bariumruthenaat:een hoog rendement, gemakkelijk te hanteren perovskietkatalysator voor de oxidatie van sulfiden
Bariumruthenaat:een hoog rendement, gemakkelijk te hanteren perovskietkatalysator voor de oxidatie van sulfiden Onderzoekers onderzoeken hersenziekte-veroorzakende eiwitten op atomair niveau
Onderzoekers onderzoeken hersenziekte-veroorzakende eiwitten op atomair niveau Optimalisatie van elektrische velden levert betere katalysatoren op
Optimalisatie van elektrische velden levert betere katalysatoren op Voedingskleurstoffen neutraliseren in Water
Voedingskleurstoffen neutraliseren in Water Nieuwe manier gevonden om nummer zeven plastic om te zetten in waardevolle producten
Nieuwe manier gevonden om nummer zeven plastic om te zetten in waardevolle producten
 Nu stikken Australische steden in rook, gaan we het eindelijk over klimaatverandering hebben?
Nu stikken Australische steden in rook, gaan we het eindelijk over klimaatverandering hebben? Studie kijkt naar kwetsbaarheid aardbeving San Francisco
Studie kijkt naar kwetsbaarheid aardbeving San Francisco De Amerikaanse kastanje herstellen door zijn genoom te onderzoeken
De Amerikaanse kastanje herstellen door zijn genoom te onderzoeken Uit nieuw onderzoek blijkt dat baby's op weg naar school meer worden blootgesteld aan schadelijke vervuiling dan op weg naar huis
Uit nieuw onderzoek blijkt dat baby's op weg naar school meer worden blootgesteld aan schadelijke vervuiling dan op weg naar huis Wat voor soort boonzaad te gebruiken voor een wetenschappelijk experiment
Wat voor soort boonzaad te gebruiken voor een wetenschappelijk experiment
Hoofdlijnen
- Onderzoeksgroep ontdekt de oorsprong van octopussen onmiddellijke modulatie van lichaamskleuring
- Chloroplast & Mitochondria: wat zijn de overeenkomsten en verschillen?
- Hoe maak je een 3-D DNA-model voor High School Biology
- Waarom lijken haaienbeten dodelijker in Australië dan elders?
- Hoe zangvogels een nieuw lied leren
- Nachtsnacks van vleermuizen onthullen aanwijzingen voor het beheer van bedreigde diersoorten
- Wat is het dominante fenotype?
- Hoe worden restrictie-enzymen gebruikt?
- De gezondheid van larven van een Antarctische koudwaterkoraalsoort kan resistent zijn tegen opwarmend water
- Wetenschappers zuiveren koperen nanodraden

- Nanodeeltjes om kankercellen met hitte te doden
- Nieuw fenomeen in magnetische wervels van nanoschijven

- Nieuwe katalysator van platina-nanodeeltjes kan leiden tot conk-out-vrije, stabiele brandstofcellen
- Nieuwe methode voor massaproductie van hoogwaardige DNA-moleculen
 theoretisch, twee lagen zijn beter dan één voor de efficiëntie van zonnecellen
theoretisch, twee lagen zijn beter dan één voor de efficiëntie van zonnecellen Slechts een op de vier West-Romeinse keizers stierf een natuurlijke dood
Slechts een op de vier West-Romeinse keizers stierf een natuurlijke dood NASA-astronaut, de eerste die ongebonden in de ruimte vloog, sterft bij 80
NASA-astronaut, de eerste die ongebonden in de ruimte vloog, sterft bij 80 Welke aanpassingen hebben planten en dieren in zoutwaterbiomen?
Welke aanpassingen hebben planten en dieren in zoutwaterbiomen?  TIC-TOC-technologie brengt Tactile Internet een stap dichter bij de realiteit
TIC-TOC-technologie brengt Tactile Internet een stap dichter bij de realiteit Ruimte tuinieren
Ruimte tuinieren Oxide nanosheets overtroeven de huidige state-of-the-art condensatormaterialen
Oxide nanosheets overtroeven de huidige state-of-the-art condensatormaterialen Wetenschappers identificeren schadelijke bacteriën op basis van hun DNA tegen zeer lage kosten
Wetenschappers identificeren schadelijke bacteriën op basis van hun DNA tegen zeer lage kosten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

