
Wetenschap
Eenvoudige, goedkope, snelle en nauwkeurige nanosensoren lokaliseren infectieziekten
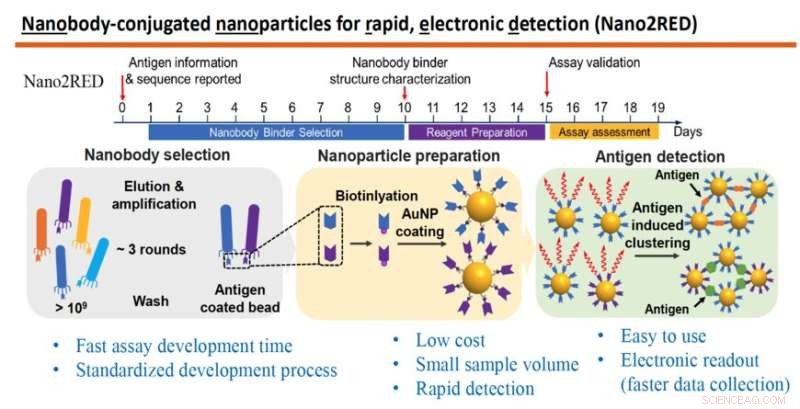
De afbeelding benadrukt de belangrijkste kenmerken van Nano2RED, een innovatieve diagnostische methode die is uitgevonden door professor Wang en zijn collega's. Het bovenste gedeelte illustreert de snelle tijdlijn van stappen voor de productie van de test, die allemaal in ongeveer 20 dagen kunnen worden uitgevoerd. Het middelste gedeelte van de afbeelding toont de betrokken basisstappen. Eerst wordt een grote bibliotheek van synthetische antilichamen of nanobodies geproduceerd en gescreend tegen een bekend antigeen (links), vervolgens worden nanobodies gehecht aan gouden nanodeeltjes (midden) en ten slotte worden ziekteantigenen gedetecteerd in een monster wanneer gouden nanodeeltjesgebonden nanobodies samensmelten met hen, wat een positief testresultaat oplevert, (rechts). Krediet:Wang-lab
In de afgelopen jaren zijn dodelijke infectieziekten, waaronder ebola en COVID-19, naar voren gekomen om wijdverbreide menselijke verwoesting te veroorzaken. Hoewel onderzoekers een reeks geavanceerde methoden hebben ontwikkeld om dergelijke infecties op te sporen, heeft de bestaande diagnostiek te maken met veel beperkingen.
In een nieuwe studie beschrijft Chao Wang, een onderzoeker aan het Biodesign Institute en School of Electrical, Computer &Energy Engineering van de Arizona State University, samen met ASU-collega's en medewerkers aan de University of Washington (UW), Seattle een nieuwe methode voor het detecteren van virussen zoals Ebola-virus (EBOV) en SARS CoV-2.
De techniek, bekend als Nano2RED, is een slimme variant op conventionele uiterst nauwkeurige tests die gebaseerd zijn op complexe testprotocollen en dure uitleessystemen. De nanosensoren in de oplossing ("Nano2" in de naam) dienen om ziekteantigenen in een monster te detecteren door eenvoudig te mengen. Het innovatieve Rapid and Electronic Readout-proces ("RED") dat in het Wang-lab is ontwikkeld, levert testresultaten, die detecteerbaar zijn als een kleurverandering in de monsteroplossing, en de gegevens worden vastgelegd via goedkope halfgeleiderelementen zoals LED's en fotodetectoren.
De technologie betekent een belangrijke vooruitgang in de strijd tegen infectieziekten. Het kan tegen zeer lage kosten worden ontwikkeld en geproduceerd, binnen weken of dagen na een uitbraak worden ingezet en beschikbaar worden gesteld voor ongeveer 1 cent per test.
Vergeleken met veelgebruikte, zeer nauwkeurige laboratoriumtests, zoals ELISA, is Nano2RED veel gemakkelijker te gebruiken. Het vereist geen oppervlakte-incubatie of wassen, kleurstoflabeling of amplificatie, maar biedt toch een ongeveer 10 keer betere gevoeligheid dan ELISA. Bovendien ondersteunt het gebruik van halfgeleiderapparaten een zeer draagbaar digitaal uitleessysteem, dat kan worden ontwikkeld en geproduceerd tegen een prijs van slechts een paar dollar, waardoor het niet alleen ideaal is voor gebruik in laboratoria, maar ook voor klinieken, thuisgebruik en op afstand of locaties met beperkte middelen. Deze aanpak is gebaseerd op modulaire ontwerpen en zou mogelijk kunnen worden gebruikt om op elke ziekteverwekker te testen.
"Deze technologie werkt niet omdat ze complex is, maar omdat ze eenvoudig is", zegt professor Wang. "Een ander uniek kenmerk is de multidisciplinaire aard van biosensing. Een fundamenteel begrip van biochemie, fluïdica en opto-elektronica heeft ons geholpen om zoiets 'eenvoudigs' te bedenken."
Wang is onderzoeker bij het Biodesign Center for Molecular Design and Biomimetics aan de ASU. Hij is ook een onderzoeker bij ASU's School of Electrical, Computer and Energy Engineering; en het Centrum voor Fotonische Innovatie. Dr. Liangcai Gu is de medewerker bij de afdeling Biochemie en het Instituut voor Eiwitontwerp aan de UW, Seattle.
Het onderzoek verschijnt in het huidige nummer van het tijdschrift Biosensors and Bioelectronics . Dr. Xiahui Chen en Md Ashif Ikbal van ASU en Dr. Shoukai Kang van UW zijn de eerste auteurs, en Jiawei Zuo en Yuxin Pan zijn de andere bijdragende auteurs.
Het testprobleem
Epidemiologen kennen de basisformule al lang als ze geconfronteerd worden met een ziekte-uitbraak. Om gevallen te identificeren en de besmetting te stoppen, is het noodzakelijk om een nauwkeurige test of test te ontwikkelen die de ziekte kan identificeren, en vervolgens vroeg en vaak te testen om de verspreidingssnelheid te beoordelen en te proberen de geïnfecteerden te isoleren.
Helaas is de uitbraak van de ziekte vaak al wijdverbreid en moeilijk te beheersen tegen de tijd dat een nieuwe diagnose is ontwikkeld, vervaardigd en verspreid. Verder zijn nauwkeurige tests, waaronder PCR (die minuscule niveaus van pathogene nucleïnezuren kunnen versterken tot meetbare niveaus), vaak duur, arbeidsintensief en vereisen geavanceerde laboratoriumfaciliteiten.
De ebola-epidemie van 2014-2016, hoewel grotendeels beperkt tot West-Afrika, verspreidde zich met angstaanjagende snelheid, veroorzaakte paniek en doodde meer dan 11.000 mensen. De dodelijkheid van het virus, een van de hoogste voor alle bekende ziekteverwekkers, kan meer dan 90% bedragen, afhankelijk van de ziektestam. De crisis werd verergerd door een combinatie van ontoereikende bewakingssystemen en een slechte infrastructuur voor de volksgezondheid.
SARS CoV-2, hoewel minder dodelijk dan ebola, heeft zich naar elk land op aarde verspreid en heeft wereldwijd al meer dan 5,6 miljoen mensen gedood. Bij beide ziekte-uitbraken kwamen diagnostische tests laat ter plaatse. Verder hebben dure en omslachtige testvereisten ertoe geleid dat er veel te weinig tests zijn uitgevoerd, zelfs na hun succesvolle ontwikkeling.
De nieuwe studie past zijn innovatieve methode toe om op deze twee prominente ziekten te testen als een proof of concept.
Vloedgolf
Een gemeenschappelijk kenmerk van veel ziekte-uitbraken is de bliksemsnelheid waarmee een ziekteverwekker, nadat hij eerst een handvol mensen heeft besmet, momentum kan krijgen, in alle richtingen kan uitwaaieren en ziekenhuizen en zorgverleners snel kan overweldigen. Cutting off a pathogen's routes of transmission requires identifying and isolating sick individuals through testing, as quickly as possible.
During a pandemic like COVID-19, the sensitivity of a given diagnostic test is secondary to how often the test is given and how long it takes for results to be processed. A highly sensitive test is of limited use if it can only be given once, and results require a weeks-long turnaround. Research has shown that infection outbreaks are best controlled when testing is repeated in less than 3-day intervals and at a large scale.
Adequately preparing society for current and future outbreaks of infectious disease will require faster, cheaper, more accurate and more easily usable diagnostics.
Close affinity
The new technology can identify secreted glycoprotein (sGP), a telltale fingerprint of Ebola virus disease and the SARS-CoV-2 spike protein receptor binding domain (RBD). The technology is highly accurate, rivaling ELISA, a long-recognized gold standard technology for diagnostic testing.
The basic idea of such diagnostics, known as immunoassays, is simple:A sample of blood (or other biological fluid) is applied to the assay, which is adorned with antibodies. When antibodies recognize the presence of a corresponding disease antigen in the sample, they bind with it, producing a positive test result. In the ELISA test, the disease antigen needs to be immobilized on a flat surface.
Nano2RED also relies on binding affinity for positive diagnosis but instead uses floating gold nanoparticles for readout. Unlike ELISA, Nano2RED can be developed from scratch in roughly 10 days and theoretically applicable for any pathogen, providing vitally important early surveillance in the case of a disease outbreak. It can deliver test results in 15-20 minutes and may be administered at an estimated cost of a penny per test. In the current study, the new test was shown to detect Ebola's sGP in serum with a sensitivity roughly 10 times better than ELISA.
Sensing danger
In this method, the first step is to produce a very large library containing over a billion random amino acid sequences, known as nanobodies, which can act as synthetic antibodies, able to bind with target disease antigens. This vast library of nanobodies is then successively screened against the antigen in question, for example, sGP in the case of Ebola. Only those nanobodies that show strong binding affinity for the antigen are used for sensing.
Next, the selected nanobodies are affixed to gold nanoparticles that will act as probes to identify and bind with antigens present in a blood sample. In the study, a pair of two high affinity nanobodies were selected and attached to gold nanoparticles. This approach improves both the sensitivity and specificity of the test.
The key innovation of Nano2RED is the way the antigen detection is registered. As disease antigens in the sample are recognized by the nanobodies, they bind together, forming clusters of bound nanobody and antigen, like islands of algae floating on the sea surface. "Basically, an antigen works like superglue to bring the nanoparticle together," Wang says.
A 'golden' opportunity in the fight against infectious disease
The gold nanoparticles provide a stable platform to hold the nanobodies in place. Once enough binding has taken place, the bound clusters begin to sink to the bottom of the vessel. This can be detected with the naked eye in the form of a color change. The solution becomes lighter in color as the gold-nanoparticle-carried antigen-antibody clusters precipitate out, signaling detection of the pathogen.
While full precipitation of nanoparticle clusters leading to a test result can normally take several hours, the process can be sped up by centrifuging the sample, which eliminates the wait time for precipitation. In this case, just 15-20 minutes are sufficient for a result. "Of course, the gold nanoparticles are heavy, and that helps quick sedimentation, too." Wang added.
Gold nanoparticles also work to display color, not yellow but red, by absorbing light from a narrow spectral range. This absorbance feature allowed the Wang lab to invent a tiny, inexpensive device that converts this color change into an electrical signal, using color-matching semiconductor LEDs and photodetectors. Such instruments produce a rapid and accurate readout of assay results, whose limits of detection are comparable to or better than costly lab-based spectroscopy methods.
The test also delivers quantitative results based on amount of antigen detected. This could be vitally useful for estimating disease severity as well as time elapsed since the infection event. In the future, the test results can be digitized by circuits and conveniently transmitted via internet to anywhere in the world for data analysis and further scrutiny, which could be important to government policy decision-making processes and timely interruption of the transmission.
Nano2RED requires only a tiny blood sample, typically around 20 microliters. "This also makes gold inexpensive in our case, because the mount we need is so tiny," Wang said. Unlike conventional methods, Nano2RED is also very simple to use with minimal training involved for healthcare personnel. It does not require any time-consuming and expensive incubation, washing, fluorescent labeling or amplification.
Future research will help improve the assay's limits of detection even further and modify its detection capacities to include virion particles, extracellular vesicles, small molecules, and nucleic acids.
"There is certainly still a lot to explore," Wang added, "but we so far have a happy marriage between engineering disciplines and biology. And that is what we will continue to work on." + Verder verkennen
Development of home COVID-19 test comparable to PCR accuracy, selectivity
 Uitleg van het concept van elektronegativiteit
Uitleg van het concept van elektronegativiteit Wetenschapsproject over hoe een ei te drijven
Wetenschapsproject over hoe een ei te drijven Een betere zoutvanger bouwen:wetenschappers synthetiseren een moleculaire kooi om chloride op te vangen
Een betere zoutvanger bouwen:wetenschappers synthetiseren een moleculaire kooi om chloride op te vangen Mechano-responsieve hydrogel ontwikkeld voor wondgenezing
Mechano-responsieve hydrogel ontwikkeld voor wondgenezing Wat gebeurt er in een Lewis-zuur-base-reactie?
Wat gebeurt er in een Lewis-zuur-base-reactie?
Hoofdlijnen
- Algoritme legt uit hoe mieren padennetwerken maken en repareren
- Het ochtendkoor horen:Okina was een nieuw akoestisch monitoringnetwerk
- Niet zomaar een back-up, de dubbele specificiteit van UBA6
- Hoe slaaplabs werken
- Wat zijn de verschillen tussen PCR en klonen?
- Projectideeën om het menselijke spijsverteringsstelsel te laten zien op de middelbare school voor studenten
- Ethics of Genetic Engineering
- Puin van de tsunami van 2011 bracht honderden soorten over de Stille Oceaan
- Een zwaartekrachttheorie ontwikkelen voor ecologie
- De microscopische oorsprong van efficiëntieverlies in LED's

- Ontwerp van nanodeeltjesnetwerken verbeterd door theorie
- Grafeen nanolinten als elektronische schakelaars

- Colloïdale nanodiscs gebruiken voor het 3D bioprinten van weefsels en weefselmodellen

- PPPL bestudeert de rol van plasma's bij het synthetiseren van nanodeeltjes

 Binnenkort kun je met je gewone telefoon bellen via de satelliet
Binnenkort kun je met je gewone telefoon bellen via de satelliet Betere supergeleiders van keramische koperoxiden
Betere supergeleiders van keramische koperoxiden Een solvatatieproces stap voor stap volgen
Een solvatatieproces stap voor stap volgen De effecten van overbevolking van dieren
De effecten van overbevolking van dieren Een stap dichter bij praktische zonne-waterstofproductie via uitgebreid gemodificeerde hematiet-fotoanode
Een stap dichter bij praktische zonne-waterstofproductie via uitgebreid gemodificeerde hematiet-fotoanode Nieuwe discipline voorgesteld:Macro-energiesystemen - de wetenschap van de energietransitie
Nieuwe discipline voorgesteld:Macro-energiesystemen - de wetenschap van de energietransitie Naarmate het klimaat op aarde verandert,
Naarmate het klimaat op aarde verandert,  Mijlenlange olieramp in de Golf nadat Ida onderzoek heeft gedaan door kustwacht
Mijlenlange olieramp in de Golf nadat Ida onderzoek heeft gedaan door kustwacht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

