
Wetenschap
Schuifwanden - een nieuw paradigma voor microfluïdische apparaten
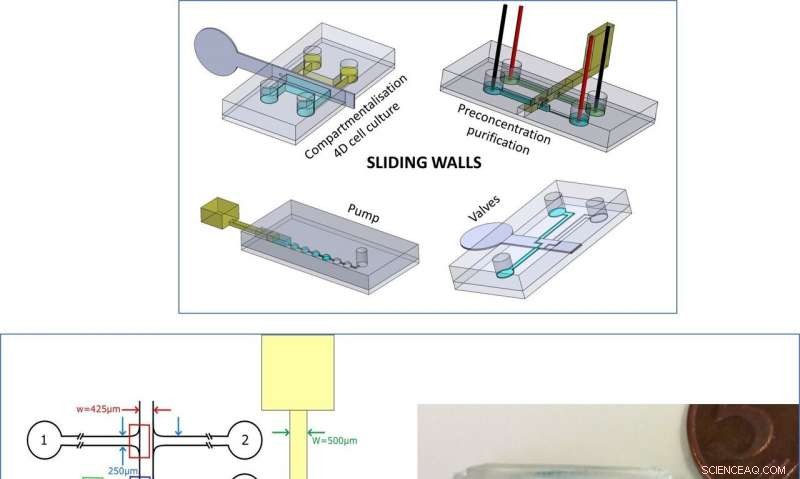
Boven:Samenvatting van de nieuwe technologie. Links:Ontwerp van de microchip en schuifwand voor DNA-preconcentratie. Rechts:Afbeelding van de microchip en schuifwand voor experimenten met compartimentering. Er zijn blauwe en gele kleurstoffen toegevoegd voor visualisatie. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0125-7
Een onderzoeksteam heeft onlangs "schuifwanden" ontwikkeld als een nieuwe techniek voor vloeistofcontrole in microfluïdische apparaten, waardoor halfstijve of stijve wanden in een microfluïdische chip kunnen schuiven. In een nieuw verslag nu op Natuur:microsystemen en nano-engineering , Bastien Venzac en een team van wetenschappers aan het Instituut Curie en Sorbonne University in Parijs, Frankrijk, verschillende vloeistoffuncties ontworpen met behulp van schuifwandgeometrie. Het apparaat bevatte aan/uit-schakelkleppen om kanalen te blokkeren of opnieuw te configureren, afhankelijk van de wandgeometrie. De opstelling bevatte een op hydrogel gebaseerd membraan om te concentreren, zuiveren en transporteren van biomoleculen van het ene kanaal naar het andere. De techniek is compatibel met zachte lithografiemethoden voor eenvoudige implementatie op basis van typische fabricageworkflows op polydimethylsiloxaan (PDMS)-chips. De nieuwe methode opent een weg naar een verscheidenheid aan microfluïdische toepassingen, eenvoudig vormen, met de hand aangedreven apparaten voor point-of-care-toepassingen in biologische laboratoria.
Echt herconfigureerbare systemen zijn de droom van een microfluïdische ingenieur, waar remodelleren slimme systemen beschrijft die in modulaire eenheden zijn gebouwd en geassembleerd voor snelle reorganisatie tussen experimenten. Voor de meeste microfluïdische systemen, echter, het kanaalnetwerk blijft vast tijdens microfabricage en kan tijdens het experiment niet op maat worden geherstructureerd. Ingenieurs kunnen ook alleen veranderingen in pompen, klep of gebruik externe krachten van elektriciteit en magnetische velden. Om te voldoen aan de bestaande limieten of uitdagingen van microfluïdische productie, Venzac et al. stelde een nieuw concept voor voor microfluïdische bediening, bekend als "schuifwanden". De methode is compatibel met fabricage van zachte lithografie, maar vereist geen externe apparatuur. Het kan handmatig worden bediend en kan worden opgenomen in een enkel apparaatcomponent.
Venzac et al. ontwikkelde schuifwanden met behulp van verschillende productiemethoden om ze te engineeren in open kanalen van polydimethylsiloxaan (PDMS) -chips. Dankzij het activeringsproces konden ze een kanaal dat vloeistoffen verpompt omkeerbaar openen of sluiten. heroriënteer vervolgens stromen om naar believen een microfluïdisch netwerk te herconfigureren. Het team beschreef het principe van de methode en demonstreerde eenvoudige functies, waaronder de vorming van een hydrogelplaat voor vierdimensionale (4-D), gecontroleerde celcultuur, gevolgd door op membraan gebaseerde elektrokinetische DNA-preconcentratie in microfluïdische compartimenten. Ze implementeerden de technologie tegen lage kosten voor snelle prototyping en bedienden de schuifwanden handmatig voor eenvoud, het team zou de wanden ook volledig kunnen automatiseren met behulp van computergestuurde motoren of actuatoren. De nieuwe toolbox is goed aangepast voor toepassingen met microfluïdische kanaalafmetingen van meer dan 100 µm en vereist slechts enkele bedieningselementen.
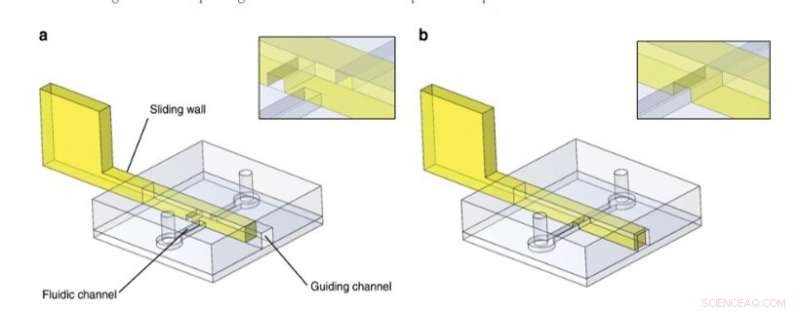
Schuifwandprincipe. PDMS-structuren bevatten een geleidingskanaal en een fluïdisch kanaal en waren gebonden aan een vlak PDMS-oppervlak. In dit voorbeeld, een schuifwand met een gegraveerd kanaal werd na chipfabricage in het geleidingskanaal geplaatst. Het vloeistofkanaal was a geblokkeerd of b vrij. Details van de kruising van de schuifwand/het fluïdische kanaal zijn te vinden in de inzetstukken. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0125-7
Voor het algemene ontwerpprincipe, de onderzoekers plaatsten een stijve/semi-rigide structuur in een geleidingskanaal in de PDMS microfluïdische chip en gebruikten een verscheidenheid aan materialen om schuifwanden te ontwikkelen, waaronder (1) roestvrijstalen films, (2) foto-uithardbare resist gefotopolymeriseerd in PDMS-vormen, en (3) foto-uithardbare hars gegoten met behulp van stereolithografisch 3D-printen. Ze selecteerden de technische technieken die bij het experiment pasten op basis van hun intrinsieke eigenschappen en voorkwamen het knikken of breken van de muur tijdens de bediening door de materiaalstijfheid te regelen, waarbij roestvrij staal de voorkeur gaf voor de meeste dunne schuifwanden. Voor grotere schuifwanden gebruikten ze conventionele stereolithografie en gebruikten ze microfrezen op roestvrij staal om kleine details op een schuifwand op te nemen.
Als eerste proof-of-concept, Venzac et al. twee soorten kleppen voorbereid:een aan/uit-klep en een metalen schakelklep met één inlaat en twee uitlaten. De schuifkleppen zijn vooral interessant vanwege hun bruikbaarheid in organ-on-chip-apparaten en celcultuurconstructies. De onderzoekers toonden ook het gebruik van schuifwanden als on-chip-spuiten om vloeistoffen handmatig te pompen en observeerden geen vloeistoflekkage tijdens het duwen of aanzuigen van lucht in de experimenten. De schuifwanden waren vindingrijk voor de constructie van grote kamers - het team voegde twee smalle groeven toe aan het kamerdak en de vloer om een verticale roestvrijstalen schuifwand te geleiden en de communicatie tussen de compartimenten te regelen.
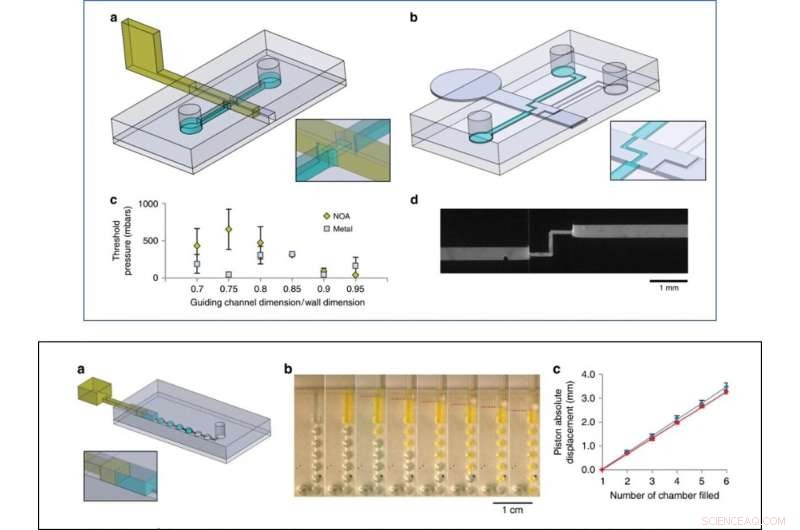
TOP:kleppenexperimenten. een ontwerp van de chip en foto-uithardbare op resist gebaseerde schuifwand voor het aan-uit-klepexperiment. b Ontwerp van de chip en de metalen schuifwand voor het wisselklepexperiment. c Maximale druk die wordt weerstaan door op resist gebaseerde (gele reeks) en op metaal gebaseerde wanden (grijze reeks) voor verschillende verhoudingen tussen het geleidingskanaal en de schuifwandhoogtes en -breedtes (drie experimenten per conditie). d Fluorescerend beeld van de schakelklep met met fluoresceïne beladen water dat door het open pad stroomt (13 µl/s). BODEM:Pompexperiment. een chip-ontwerp, b Opeenvolgende foto's van het pompen van met fluoresceïne beladen water door kamers van 1 l. De positie van de zuiger wordt aangegeven met rode stippellijnen. c Vloeistofverplaatsing versus absolute zuigerverplaatsing (de oorsprong van de zuiger werd ingesteld bij het begin van de vulling van de eerste kamer), voor duwen (blauw) dan trekken (rood), gemiddeld over vier verschillende apparaten. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0125-7
Het team voerde uiteindelijk biofunctionalisatietests uit met behulp van het nieuwe apparaat en observeerde 4-D-celcultuur en celmigratie. In dit experiment, ze laadden een fluorescerende collageenoplossing in de rechterhelft van de kamer, vulde de tweede helft met buffer en mengde de twee om een hydrogelplaat te maken. Dergelijke hydrogels zijn een belangrijke vereiste om 3D-orgaan-op-chip-compartimenten te ontwikkelen. Om hun biologische functie te testen, Venzac et al. bestudeerde celmigratie met dendritische cellen (immuuncellen) geladen in de collageenoplossing in een kamer. Het team vulde het tweede compartiment met een chemokine-oplossing en verwijderde de roestvrijstalen schuifwand om een rechte interface te creëren waardoor de chemoattractant op de collageenplaat kan diffunderen zodat de dendritische cellen naar de gel/oplossing-interface kunnen migreren. het vormen van een 4-D celcultuur.
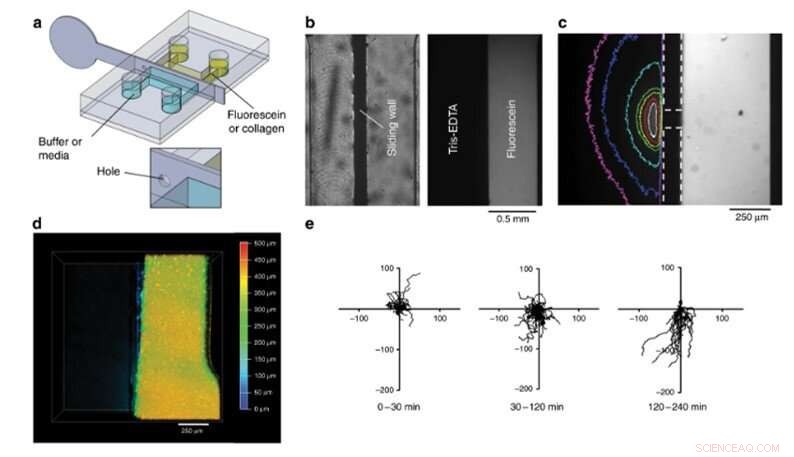
Compartimentering experimenten. (a) Ontwerp van de chip en de metalen schuifwand. (b) Foto's van bovenaanzicht van een afdichtingstest. Links:heldere foto van de kamer. Rechts:fluorescerend beeld van de kamer na 8 h. (c) Gradiënt van fluoresceïne in het Tris-EDTA-buffercompartiment na plaatsing van een gat van 200 m in de schuifwand in de kamer. Schuifwand- en gatgrenzen zijn aangegeven met de stippellijnen. De kleurlijnen komen overeen met het beeldoppervlak met een intensiteit hoger dan 12% van de maximale waarde (wit:1 s, rood:4 s, geel:9 s, groen:14 s, cyaan:50 s, blauw:110 s, magenta:170 s na verplaatsing van de muur). (d) Bovenaanzicht, dieptegecodeerde confocale afbeelding van een fluorescerende, gegeleerde collageenplak rechts, halve bodem van de kamer na verwijdering van de schuifwand. (e) Trajecten van dendritische cellen in de collageenplaat vóór verwijdering van de schuifwand (0-30 min) en na verwijdering van de schuifwand (30-240 min) ontleed in twee perioden. De eerste toonde geen preferentiële migratie (30-120 min), terwijl cellen worden aangetrokken door het chemokine-compartiment van 120 tot 240 min. De assen zijn in micrometer, en de verticale as wijst weg van het chemokine-compartiment. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0125-7
Ze hebben ook elektrokinetisch voorgeconcentreerde DNA-macromoleculen, gecontroleerd hun transport en release in de nieuwe opstelling. Om dit te bereiken, het team gebruikte een beweegbaar en herconfigureerbaar hydrogelmembraan in de microfluïdische systemen en ontwierp een schuifwand met een geïntegreerd venster met behulp van 3D-printen met hoge resolutie. Ze pasten een constant elektrisch veld toe in de kanalen om elektroforetische migratie van DNA-gelabeld met een fluorescerende tag in bufferoplossing mogelijk te maken. De grootte van de hydrogelporiën verhinderde DNA-migratie, waardoor ze zich vooraf concentreren op het membraan. De wetenschappers veroorzaakten een vrije stroom van voorgeconcentreerd DNA in de opstelling, om monsters van het ene kanaal naar het andere te transporteren, als een nieuwe en eenvoudige route voor monstervoorbereiding en analyse.
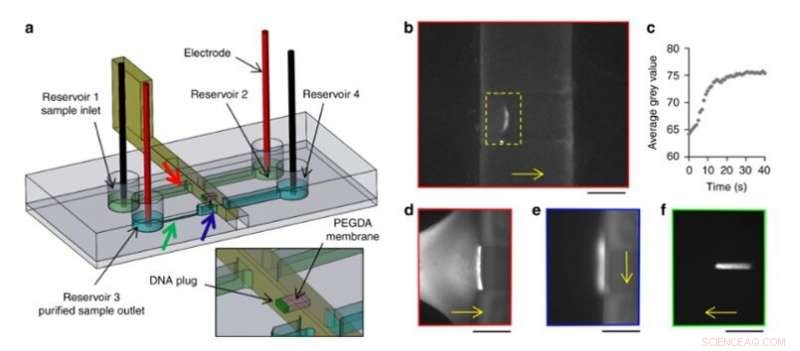
DNA-voorconcentratie en zuiveringsexperiment. (a) Ontwerp van de chip en de schuifwand. Een PEGDA-membraan (roze) werd gefotopolymeriseerd in het venster van een schuifwand. Gekleurde pijlen geven de locatie van de volgende afbeeldingen aan met de bijbehorende gekleurde rand. (b) Preconcentratie door elektroforese van 100 pg Lambda-DNA tegen het PEGDA-membraan in een 3D-geprinte schuifwand. (c) Evolutie in de tijd van de gemiddelde grijswaarde binnen de gele rechthoek van b). (d) Fluorescerende afbeeldingen van DNA tijdens preconcentratie tegen het PEGDA-membraan, (e) na verplaatsing naar het tweede kanaal en (f) elektroforetische afgifte. Schaalbalken:250 m. DNA-migratie- of verplaatsingsrichtingen worden aangegeven door de gele pijlen. Krediet:microsystemen en nano-engineering, doi:10.1038/s41378-019-0125-7
Op deze manier, Bastien Venzac en collega's ontwikkelden een nieuwe toolbox om het gebruik van conventionele microfluïdica te innoveren. De schuifwanden hadden extra functies zoals microkanalen of vensters met geladen gels en oplossingen voor mogelijke toepassingen die verder gaan dan die van conventionele in-chip-kleppen. Opmerkelijk, ze bereikten 4-D-celkweek en DNA-preconcentratie met behulp van de opstelling met een enkele schuifwand. De wetenschappers zien de techniek in brede toepassingen voor goedkope en low-tech biomedische omgevingen.
© 2020 Wetenschap X Netwerk
 Factoren die de pH van water in Wetlands
Factoren die de pH van water in Wetlands Een glas water met rode kleurstof terugdraaien in helder water
Een glas water met rode kleurstof terugdraaien in helder water Wat zijn de te onthouden voorzorgsmaatregelen bij het gebruik van een micropipet?
Wat zijn de te onthouden voorzorgsmaatregelen bij het gebruik van een micropipet?  Wetenschappers vinden handapparaat uit voor snelle bewaking van drinkwaterkwaliteit
Wetenschappers vinden handapparaat uit voor snelle bewaking van drinkwaterkwaliteit Zelfmontage, biomimetische composieten hebben ongebruikelijke elektrische eigenschappen
Zelfmontage, biomimetische composieten hebben ongebruikelijke elektrische eigenschappen
 Nieuw onderzoek van Arctic:Ontdooiende permafrost-veengebieden kunnen bijdragen aan atmosferische CO2-belasting
Nieuw onderzoek van Arctic:Ontdooiende permafrost-veengebieden kunnen bijdragen aan atmosferische CO2-belasting Menselijke activiteiten drogen de Amazone uit:NASA-studie
Menselijke activiteiten drogen de Amazone uit:NASA-studie Zee van plastic:Med-vervuiling in de schijnwerpers tijdens Conservation Meet
Zee van plastic:Med-vervuiling in de schijnwerpers tijdens Conservation Meet Afnemend Arctisch zee-ijs beïnvloedt het Europese weer, maar is geen oorzaak van koudere winters
Afnemend Arctisch zee-ijs beïnvloedt het Europese weer, maar is geen oorzaak van koudere winters Permafrost in continue beweging
Permafrost in continue beweging
Hoofdlijnen
- Experts:broederij in Idaho die is gebouwd om zalm te redden doodt ze
- Verschil tussen homozygoot en heterozygoot
- Zelfvernietiging van muggen
- De rol van de longen
- Zuid-Amerikaanse brulapen zijn mogelijk meer bedreigd dan eerder werd gedacht
- Dieetbeperking en levensduur bij mannelijke en hermafrodiete wormen
- Een ellebooggewricht bouwen Model
- Hoe zijn fytoplankton reproductie?
- Hoeveel chromosomen zijn er in cellen van het menselijk lichaam?
- Nieuwe onderzoeksopening voor atomair dunne metalen nanostructuren

- Groen licht op goudatomen:Nano-antennes maken nano-defecten zichtbaar voor het blote oog

- Kankercellen oplichten om lage concentraties zieke cellen te identificeren
- Wetenschappers bedenken een benadering met een Trojaans paard om kankercellen te doden zonder medicijnen te gebruiken

- AI-aangedreven dynamisch gezichtsmasker past zich aan om te oefenen, vervuilingsniveaus

 Menselijke interactie met Coral Reefs
Menselijke interactie met Coral Reefs Synthetische receptoren kunnen celfuncties opnieuw bedraden en bijwerkingen minimaliseren
Synthetische receptoren kunnen celfuncties opnieuw bedraden en bijwerkingen minimaliseren Hogere planten verhuizen naar het noordpoolgebied vanwege klimaatverandering
Hogere planten verhuizen naar het noordpoolgebied vanwege klimaatverandering Topologische materialen voor informatietechnologie bieden verliesvrije overdracht van signalen
Topologische materialen voor informatietechnologie bieden verliesvrije overdracht van signalen Raman-spectroscopie klaar om de diagnose van schildklierkanker minder invasief te maken
Raman-spectroscopie klaar om de diagnose van schildklierkanker minder invasief te maken Grote vooruitgang voor elektronische gadgets van de toekomst
Grote vooruitgang voor elektronische gadgets van de toekomst NASA onderzoekt helderheidstemperaturen van Tropical Cyclone 15W
NASA onderzoekt helderheidstemperaturen van Tropical Cyclone 15W Hoe ID Mountain Lion Poop
Hoe ID Mountain Lion Poop
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

