
Wetenschap
Diersimulaties en slim medicijnontwerp:transport van nanomateriaal naar individuele cellen

In vitro toepassing van assay met behulp van meerdere celtypen met simulatie en snelheidsextractie. (A) Fluorescentiegegevens en testopstelling die ongewassen QD (QSH) fluorescentie vertegenwoordigen voor ongewassen putjes die nier bevatten (MES13), lever (AML12), endotheel (C166), en macrofaag (J774a.1) celtypen. AU, willekeurige eenheden. (B) gewassen ruwe (zwarte) en gekalibreerde (rode) fluorescentie opname concentraties (cirkels, gemeten) vergeleken met simulatiefits (lijnen) voor lever, endotheel, macrofaag, en nierceltypes. (C) Samenvatting van snelheidsconstanten geoptimaliseerd door het genetische algoritme voor modelfit aan gemeten datasets. (D) Tijdsafhankelijke confocale microscopiebeelden van QD-opname, met verzadiging (dubbelzijdige pijlen) voor elk celtype in het onderzoek (blauw en rood vertegenwoordigen celkern Hoechst en QSH-fluorescentie, respectievelijk). Cartoon is een visuele weergave van de interactiekinetiek van QD-cellen. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aax2642
Bio-ingenieurs kunnen slimme medicijnen ontwerpen voor op antilichamen en nanomaterialen gebaseerde therapieën om de efficiëntie van geneesmiddelen te optimaliseren voor steeds efficiëntere, preklinische studies in een vroeg stadium. Het ideale medicijn zal maximale efficiëntie hebben op doelweefselplaatsen voor transport van het weefselvasculatuur naar de cellulaire omgeving. Onderzoekers kunnen biologische simulaties gebruiken die zijn gekoppeld aan in vitro benaderingen om hun blootstelling snel en efficiënt te voorspellen om de biodistributie van geneesmiddelen in afzonderlijke cellen van levend dierlijk weefsel te voorspellen zonder afhankelijk te zijn van dierstudies. In een nieuwe studie die nu is gepubliceerd op wetenschappelijke vooruitgang , Edward Price en Andre J. Gesquiere gebruikten met succes een in vitro assay en computational fluid dynamic (CFD) -model om in vitro celkinetiek te vertalen naar simulaties van het hele lichaam voor meerdere soorten en soorten nanomateriaal. Het werk stelde hen in staat om de distributie van geneesmiddelen in individuele weefselcellen te voorspellen en het team verwacht dat dit werk zal verfijnen, dierproeven verminderen en vervangen, terwijl wetenschappers een frisse kijk krijgen op de ontwikkeling van geneesmiddelen.
Nanomedicijnen (NM's) in de vorm van antilichamen en synthetische nanomaterialen kunnen een aanvulling vormen op conventionele medicijnen met kleine moleculen door middel van actieve weefseltargeting, variabele circulatietijden en stabiliteit, gekoppeld aan instelbare biodistributie. Onderzoeksteams vertrouwen sterk op diermodellen om afgeleverde doses te kwantificeren, vragen opwerpen over ethiek en stijgingen in tijd en kosten. Vanuit wetenschappelijk oogpunt, weefselarchitectuurvernietiging uitgevoerd tijdens weefselhomogenisatie voor kwantificering kan kritische kennis van nanomedicijntransport in weefselcellen en vasculatuur elimineren. Een medicijn kan cellen bereiken door een optimale farmacokinetiek van plasma te vertonen om de weefselvasculatuur te bereiken. De architectuur en de diameter van de nanodeeltjes zorgen voor kritisch transport van het medicijn over de wanden van microvaten naar een geïnfecteerde of normale weefselcelomgeving.
In het huidige werk, Price en Gesquiere koppelden een in vitro/in silico simulatiebenadering om de biodistributie van NM binnen preklinische soorten (dier- en celmodellen) op het niveau van de enkele cel te voorspellen. Ze hielden rekening met verschillen in nanodeeltjesgrootte, diersoorten en vasculatuur poriegroottediameters met behulp van een vloeistofdynamisch model. Het team kwantificeerde de cellulaire NM-inhoud in situaties waarin de resultaten moeilijk te vertalen waren naar dierstudies vanwege een gebrek aan systematische perspectieven. Ze gingen ook in op bestaande experimentele problemen waarbij cellen degradatie van nanodeeltjesfluorescentie induceerden om valse negatieven te produceren.
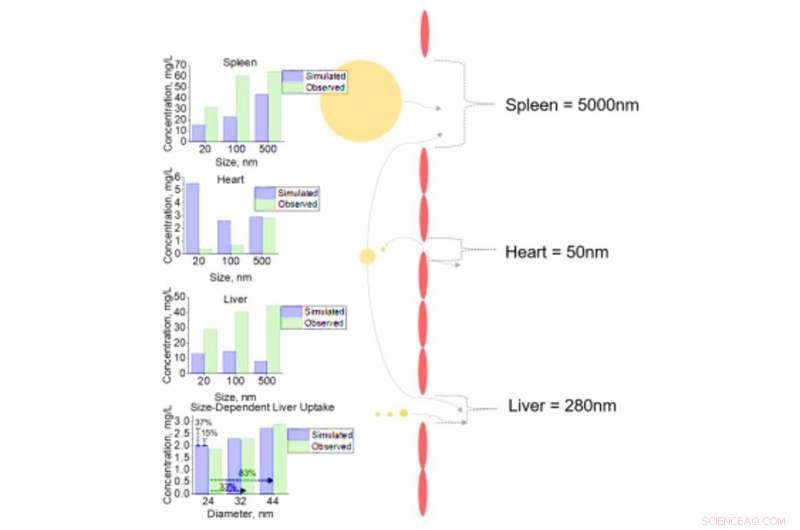
Cellulaire analyse van NM-opname in verschillende weefsels voor NM met verschillende diameters. Cellulaire opname van NM's met een diameter van 20, 100, en 500nm voor milt, hart, en lever met fenestrae diameters van 5000, 50, en 280nm respectievelijk. Gevoeligheidsanalyse van incrementele veranderingen in NM-diameter (24, 32, en 44 nm) met daaropvolgende opname door levercellen werden uitgevoerd. Alle gesimuleerde (voorspelde) outputs worden vergeleken met geobserveerde data uit cellulaire datasets uit de literatuur. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aax2642
Om hun werk in vitro te valideren, het team simuleerde lysosomale analyse gekoppeld aan atomaire absorptiespectroscopie (AAS), en onderbouwde in vivo simulaties door resultaten te vergelijken met de gepubliceerde literatuur van diergegevens over het hele lichaam voor ratten, muizen en niet-menselijke primaten. De wetenschappers gebruikten kwantumdots (QD's) als modelsysteem vanwege hun potentieel in detectie van nanodeeltjes, terwijl ze ook rekening houden met hun grenzen. Prijs et al. hield rekening met de complexiteiten in een NM-platform om de mogelijkheden uit te breiden naar op antilichaam en metaal/polymeer gebaseerde nanodeeltjes.
Wanneer een nanodeeltje door de bloedtoevoer van dieren circuleert om de weefselomgeving binnen te gaan, het zal interageren met weefselcellen via adsorptie, desorptie, internalisatie of actieve opnameprocessen. De wetenschappers stelden nanodeeltjes bloot aan niet-toxische QD's (quantum dots) om hun interacties op fluorescente wijze te detecteren met cellen die vaak worden aangetroffen door NM's, zoals macrofagen, endotheelcellen en epitheelcellen, na intraveneuze injectie. Het onderzoeksteam kwantificeerde de concentratie van nanodeeltjes die in vitro interageren met cellen en bouwde celkinetieksimulaties om de snelheidskinetiek en NM-celinteracties te beoordelen.
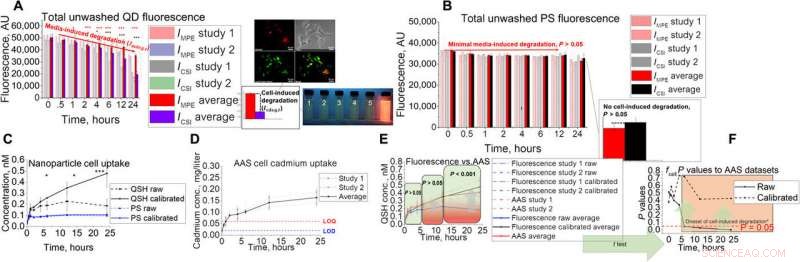
Ontwikkeling en validatie van in vitro assays voor AAS. (A en B) In vitro assay setup met zijn gekoppelde ongewassen fluorescentie signaal voor (A) QD en (B) PS. Afbeeldingen tonen Hepa1-6-colokalisatie van QD in lysosomale compartimenten, evenals snapshots van fluorescentie onder ultraviolette verlichting onder gesimuleerde lysosomale blootstellingsomstandigheden met pH 2,5, 3.0, 3,5, 4.0, 4,5, en 7,4 (1 tot 6, respectievelijk). (C tot E) QD-opnamestudies met behulp van de in vitro techniek met (C) fluorescentie, (D) AAS, (E) gecombineerd, en de (F) statistische resultaten met behulp van tweezijdige t-test bij het vergelijken van ruwe en gekalibreerde fluorescentie-opname met AAS-gegevens. De sterretjes in figuur vertegenwoordigen significantie bij de * (P <0,05), ** (P <0,01), en *** (P <0,001) niveaus. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aax2642
De simulatie bevatte een (i) medium, (ii) celmembraan en (iii) celruimtecompartimenten onderling verbonden via basismassaoverdrachtsvergelijkingen en eerste-orde snelheidsconstanten. Ze optimaliseerden het systeem met behulp van een genetisch algoritme in MATLAB en merkten op dat de membraanadsorptiesnelheidsconstante het hoogst was voor macrofagen en het laagst voor endotheel- en levercellen. Van de celtypen, het internalisatieproces was ook relatief het hoogst voor leverweefselcellen en het laagst voor endotheelcellen. Confocale beeldvorming ondersteunde deze gegevens visueel met snelle opname en verzadiging van macrofagen binnen een uur na blootstelling, terwijl epitheliale en endotheliale weefselcellen verder werden vertraagd.
Het team toonde de aanwezigheid van celafbraakfactoren aan in in vitro-assays met behulp van celkinetieksimulaties om de in vitro-gegevens efficiënt te vertalen naar dierstudies. Atoomadsorptiespectroscopie (AAS) valideerde de resultaten van QD-opname via fluorescentieassays en benadrukte het belang van het berekenen van cel- en medium-geïnduceerde afbraak. Aangezien nanomedicijnen (NM's) die zich in weefsels bevinden, zich kunnen ophopen in de interstitia, vasculatuur of in een verscheidenheid aan celtypes, het team vertaalde in vitro cellulaire kinetiek naar in silico diersimulaties om dit te verklaren. Ze voerden twee pilootstudies uit en evalueerden trends in de opname van het hele weefsel als een functie van de grootte en gekwantificeerde NM-opname op het niveau van de enkele cel. architectonisch, elke weefselcompartimentsimulatie bevatte vier subcompartimenten om het epitheliale, endotheel- en macrofaagcellen.
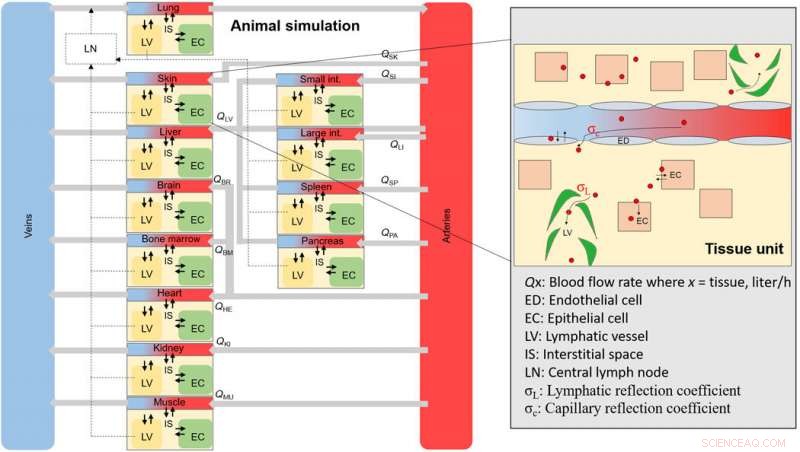
Een algemeen schema van de dierlijke NM-simulatie. Schema van de algehele weefsel- en bloedcompartimenten waaruit het volledige dier bestaat. Elk weefselcompartiment is onderling verbonden door middel van bloedstroomsnelheden en bevat subcompartimenten (ingezoomd gebied), waar een NM zich bij internalisatie door endotheliale fenestrae zal verspreiden. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aax2642
Aangezien de lever en de milt gemeenschappelijke doelen zijn voor NM-accumulatie, ze gebruikten deze weefsels als casestudy's om te begrijpen en vast te leggen, de gevoeligheid en nauwkeurigheid van de simulatie. Bijvoorbeeld, de simulatie toonde aan dat verhoogde NM-afmetingen de weefselporie-afmetingen van de meeste weefseltypes overschreden om naar weefsels met grotere porie-afmetingen zoals de lever te leiden. Op dit punt, de endotheelcellen van de lever interageerden met de NM's voor snelle membraanbinding en verzadiging binnen 24 uur. Toen de NM de interstitia van het weefsel binnenging, interageerde het snel met epitheliale (voor lever) en macrofaag (voor milt) weefselcellen. De resultaten wekten voor het eerst vertrouwen in de voorspellende kracht van de simulatie en het vermogen ervan om de inhoud van geneesmiddelen van variabele grootte op het eencellige niveau voor dieren te voorspellen - strikt gebaseerd op alleen in-vitro-gegevens.
De wetenschappers gaven vervolgens de voorspellende kracht en het translationele vermogen van de simulatie aan door te vergelijken met de gemeten inhoud op weefselniveau voor meerdere NM-typen en soorten, inclusief ratten, muizen en celinhoud (epitheel, endotheel en macrofaag). Ze testten de voorspellende prestaties over meerdere variabelen op basis van de richtlijnen van de Wereldgezondheidsorganisatie en de normen van een academisch en farmaceutisch consortium voor de ontwikkeling en veiligheid van geneesmiddelen. De door het model voorspelde gemiddelden en de waargenomen gemiddelden correleerden lineair om redelijke modelvoorspellingen voor alle soorten en NM-typen aan te geven.
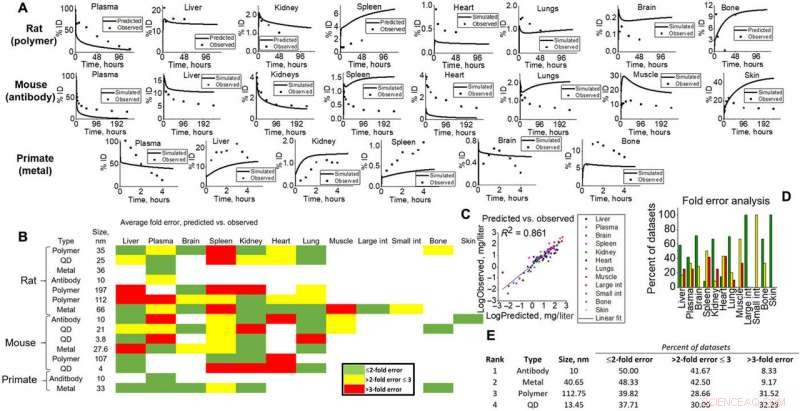
Simulatie-uitgangen voor validatie naar verschillende dierstudies. (A) Voorbeelden op weefselniveau voorspeld (lijn) versus waargenomen (punten) voor alle soorten (ratten, muizen, en NHP) voor visueel bewijs van modelmogelijkheden. (B) Heatmap van vouwfoutanalyse berekend voor al het weefsel, NL, en soortensoorten in simulatie. Groente, geel, en rood staan voor <2-voudig, <3-voudig, en>3-voudige fouten. Vouwfout werd berekend volgens vergelijkingen gegeven in Materialen en methoden, waar gesimuleerde datasetgemiddelden werden vergeleken met waargenomen. (C) Alle gegevenspuntgemiddelden die specifiek zijn voor weefseltypes voor simulaties en die werden waargenomen, werden tegen elkaar uitgezet om een lineaire pasvorm op te leveren (R2 =0,861). (D) Weefselspecifieke vouwfouten worden getoond om de modelnauwkeurigheid voor elk weefsel in deze studie te visualiseren. (E) NM-gesimuleerde uitgangen werden gerangschikt (1 tot 4) volgens vouwfoutanalyse. Credit: wetenschappelijke vooruitgang , doi:10.1126/sciadv.aax2642
Op deze manier, Edward Price en Andre J. Gesquiere ontwikkelden een levensvatbaar platform om dierproeven tijdens de ontwikkeling van nanogeneeskunde (NM) te verminderen en te verfijnen. De in vitro geconcentreerde gegevens gekoppeld aan celkinetieksimulaties leverden cel-NM-interacties op om een uitstekend translationeel potentieel aan te tonen. De resultaten hoefden niet te worden aangepast aan datasets voor biodistributie van dieren, aangezien alle parameters werden geoptimaliseerd voor in vitro-gegevens of berekend met behulp van een vloeistofdynamisch model. Het proces werkte ook onder omstandigheden van NM-degradatie in de biologische omgeving. De gecombineerde in vitro- en in silico-technieken zullen helpen bij het toekomstige slimme medicijnontwerp om wetenschappers te helpen betere en geïnformeerde discussies te voeren en tegelijkertijd het testen van levende dieren te verminderen. Price en Gesquiere verwachten dat dit werk een nieuwe benadering zal zijn voor voorspellende simulaties van transport van nanomedicijnen.
© 2020 Wetenschap X Netwerk
 Amerikaanse voorspellers voorspellen boven normaal Atlantisch orkaanseizoen
Amerikaanse voorspellers voorspellen boven normaal Atlantisch orkaanseizoen Video:Onderzoeken hoe microplastics in landbouwgrond terecht kunnen komen
Video:Onderzoeken hoe microplastics in landbouwgrond terecht kunnen komen Gevaar voor drinken Propyleenglycol
Gevaar voor drinken Propyleenglycol  Wetenschappers volgen nieuwe hittegolf op zee voor de westkust
Wetenschappers volgen nieuwe hittegolf op zee voor de westkust Regen beukt centraal Japan, gevreesde 61 doden in het zuiden
Regen beukt centraal Japan, gevreesde 61 doden in het zuiden
Hoofdlijnen
- 10 misvattingen over GGO's
- Hoe de percentages van adenine in een DNA-streng te berekenen
- Accuplacer-regels
- Wetenschappers ontdekken een genetisch mechanisme dat het opbrengstpotentieel van graangewassen zou kunnen verbeteren
- Wat is de rol van glucose in cellulaire ademhaling?
- Wat is het verschil tussen een gedupliceerd chromosoom en een chromaat?
- Menselijk genoom DNA-sequentietypen
- Ontdekt in planten een mechanisme dat defecten in eiwitvouwing corrigeert
- Onderzoek suggereert vrouwelijk voordeel in levensverwachting gerelateerd aan fundamentele biologische wortels
- Fluistergalerijmodi in silicium nanocones intensiveren luminescentie

- Een nieuwe manier om medicijnen af te leveren met nauwkeurige targeting

- Fullereen-bollen kunnen worden gebruikt om in de nanowereld te schuiven
- De atomaire paden volgen door in-situ vloeibare cel TEM

- Nanotherapie:gecontroleerde levering van chemotherapeutica om kankerstamcellen te bestrijden
 Volg NASA's Perseverance-rover in realtime op weg naar Mars
Volg NASA's Perseverance-rover in realtime op weg naar Mars Astronomen maken compositietekeningen van ongrijpbare zwervende zwarte gaten
Astronomen maken compositietekeningen van ongrijpbare zwervende zwarte gaten Welke cellen zou je gebruiken om DNA van een levende persoon te extraheren?
Welke cellen zou je gebruiken om DNA van een levende persoon te extraheren?  Fiat Chrysler betaalt $ 515 miljoen in Amerikaanse dieselgate-schikkingen
Fiat Chrysler betaalt $ 515 miljoen in Amerikaanse dieselgate-schikkingen Afwijkende viscositeit van basaltsmelt onder mantelomstandigheden die de tijdschalen van de vroege magma-oceanen beperken
Afwijkende viscositeit van basaltsmelt onder mantelomstandigheden die de tijdschalen van de vroege magma-oceanen beperken Het mysterie van een Picasso onthuld door wetenschappers
Het mysterie van een Picasso onthuld door wetenschappers Toekomstige effecten van vervuiling
Toekomstige effecten van vervuiling Amerikaanse bedrijven wegen prijsstijgingen af naarmate de materiaalkosten stijgen
Amerikaanse bedrijven wegen prijsstijgingen af naarmate de materiaalkosten stijgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

