
Wetenschap
Energie opslaan in waterstof 20 keer effectiever met platina-nikkelkatalysator

Krediet:CC0 Publiek Domein
Katalysatoren versnellen chemische reacties, maar het veelgebruikte metaal platina is schaars en duur. Onderzoekers van de Technische Universiteit Eindhoven (TU/e), samen met Chinees, Singaporese en Japanse onderzoekers, hebben nu een alternatief ontwikkeld met een 20 keer hogere activiteit:een katalysator met holle nanokooien van een legering van nikkel en platina. TU/e-onderzoeker Emiel Hensen wil met deze nieuwe katalysator in de toekomst een elektrolyzer ter grootte van een koelkast van zo'n 10 megawatt ontwikkelen. De resultaten worden op 15 november gepubliceerd in het tijdschrift Wetenschap .
Tegen 2050, het Rijk streeft ernaar om bijna alle Nederlandse energiebehoefte uit duurzame bronnen te halen, zoals de zon of de wind. Omdat deze energiebronnen niet altijd beschikbaar zijn, het is belangrijk om de opgewekte energie op te kunnen slaan. Gezien hun lage energiedichtheid, batterijen zijn niet geschikt om zeer grote hoeveelheden energie op te slaan. Een betere oplossing zijn chemische bindingen, met waterstof als meest voor de hand liggende gaskeuze. Water gebruiken, een elektrolyseur zet (een teveel aan) elektrische energie om in waterstof, die kan worden opgeslagen. In een later stadium, een brandstofcel doet het tegenovergestelde, de opgeslagen waterstof weer omzetten in elektrische energie. Beide technologieën hebben een katalysator nodig om het proces aan te sturen.
De katalysator die helpt bij deze omzettingen is - vanwege zijn hoge activiteit - meestal gemaakt van platina. Maar platina is erg duur en relatief schaars; een probleem als we op grote schaal elektrolyzers en brandstofcellen willen gebruiken. TU/e-hoogleraar katalyse, Emiel Hensen zegt, "Mede-onderzoekers uit China ontwikkelden daarom een legering van platina en nikkel, wat de kosten verlaagt en de activiteit verhoogt."
Een effectieve katalysator heeft een hoge activiteit; het zet elke seconde meer watermoleculen om in waterstof. Hensen zegt, "Aan de TU/e we onderzochten de invloed van nikkel op de belangrijkste reactiestappen en ontwikkelden hiervoor een computermodel op basis van beelden van een elektronenmicroscoop. Met kwantumchemische berekeningen konden we de activiteit van de nieuwe legering voorspellen, en we konden begrijpen waarom deze nieuwe katalysator zo effectief is."
Met succes getest in een brandstofcel
Naast de andere keuze van metaal, de onderzoekers waren ook in staat om significante veranderingen aan te brengen in de morfologie. De atomen in de katalysator moeten een binding aangaan met de water- en/of zuurstofmoleculen om ze te kunnen omzetten. Meer bindingsplaatsen zullen dus leiden tot een hogere activiteit. Hensen zegt, "Je wilt zoveel mogelijk metalen oppervlak beschikbaar maken. De ontwikkelde holle nanokooien zijn zowel van buitenaf als van binnenuit toegankelijk. Hierdoor ontstaat een groot oppervlak, waardoor meer materiaal tegelijkertijd kan reageren." Hensen heeft met kwantumchemische berekeningen aangetoond dat de specifieke oppervlaktestructuren van de nanokooien de activiteit nog verder verhogen.
Na berekeningen in het model van Hensen, het blijkt dat de activiteit van beide oplossingen samen 20 keer hoger is dan die van de huidige platinakatalysatoren. De onderzoekers hebben dit resultaat ook gevonden in experimentele tests in een brandstofcel. "Een belangrijk punt van kritiek op veel fundamenteel werk is dat het zijn ding doet in het lab, maar als iemand het in een echt apparaat stopt, het lukt vaak niet. We hebben laten zien dat deze nieuwe katalysator werkt in een echte toepassing."
De stabiliteit van een katalysator moet zodanig zijn dat deze jarenlang in een waterstofauto of -huis kan blijven werken. De onderzoekers testten daarom de katalysator voor 50, 000 'ronden' in de brandstofcel, en zag een verwaarloosbare daling van de activiteit.
Electrolyzer in elk district
De mogelijkheden voor deze nieuwe katalysator zijn legio. Zowel in de vorm van de brandstofcel als de omgekeerde reactie in een elektrolyseur. Bijvoorbeeld, brandstofcellen worden gebruikt in auto's op waterstof, terwijl sommige ziekenhuizen al noodgeneratoren hebben met brandstofcellen op waterstof. Er kan een elektrolyseapparaat worden gebruikt, bijvoorbeeld, op windparken op zee of misschien zelfs naast elke afzonderlijke windturbine. Het transporteren van waterstof is veel goedkoper dan het transporteren van elektriciteit.
Hensens droom gaat verder. Hij zegt, “Ik hoop dat we straks in elke wijk een elektrolyse kunnen plaatsen. Dit apparaat ter grootte van een koelkast slaat overdag alle energie van de zonnepanelen op de daken in de wijk op als waterstof. De ondergrondse gasleidingen zullen waterstof in toekomst, en de cv-ketel voor huishoudelijk gebruik wordt vervangen door een brandstofcel, de laatste zet de opgeslagen waterstof weer om in elektriciteit. Zo kunnen we het beste uit de zon halen."
Maar om dit te laten gebeuren, de elektrolyseur moet nog flink doorontwikkeld worden. Samen met andere TU/e-onderzoekers en industriële partners uit de Brabantse regio, Hensen is daarom betrokken bij de opstart van het energie-instituut van de TU Eindhoven. Het doel is om de huidige commerciële elektrolyzers op te schalen naar een koelkastformaat elektrolyseur van ongeveer 10 megawatt.
 Weet u niet zeker of u al corona heeft gehad? Deze test kan het je (misschien) vertellen
Weet u niet zeker of u al corona heeft gehad? Deze test kan het je (misschien) vertellen Slimme truc maakt 20 keer snellere beeldvorming mogelijk met elektronenmicroscopie
Slimme truc maakt 20 keer snellere beeldvorming mogelijk met elektronenmicroscopie Waarom neemt het kookpunt toe als de atoomstraal in halogenen toeneemt?
Waarom neemt het kookpunt toe als de atoomstraal in halogenen toeneemt?  Zeesponzen inspireren de volgende generatie wolkenkrabbers en bruggen
Zeesponzen inspireren de volgende generatie wolkenkrabbers en bruggen Wanneer minder meer is:Designer-spleten maken glasachtige materialen veel sterker
Wanneer minder meer is:Designer-spleten maken glasachtige materialen veel sterker
 Extreme neerslaggebeurtenissen hebben altijd plaatsgevonden, maar veranderen ze?
Extreme neerslaggebeurtenissen hebben altijd plaatsgevonden, maar veranderen ze? China lanceert 's werelds eerste raket-ingezette weerinstrumenten van onbemand half-afzinkbaar voertuig
China lanceert 's werelds eerste raket-ingezette weerinstrumenten van onbemand half-afzinkbaar voertuig Bij gebruik van pyriet om de oceaan en atmosfeer van de aarde te begrijpen:denk lokaal, niet wereldwijd
Bij gebruik van pyriet om de oceaan en atmosfeer van de aarde te begrijpen:denk lokaal, niet wereldwijd Voorbeelden van stof door vulkaanuitbarstingen die de zon blokkeren
Voorbeelden van stof door vulkaanuitbarstingen die de zon blokkeren Rook van bosbranden kan de luchtkwaliteit tot ongezonde niveaus doen dalen
Rook van bosbranden kan de luchtkwaliteit tot ongezonde niveaus doen dalen
Hoofdlijnen
- Lemur-studie benadrukt de rol van voeding bij het vormgeven van het darmmicrobioom
- Gebruik van microscopen in Science
- Horzels lokken:wetenschappers ontsluiten seksferomoon van berucht honingbij-roofdier
- Wat is het dominante fenotype?
- Het verschil tussen een sporofyt en gametofyt
- Hoe water door planten beweegt
- Wat is histonacetylatie?
- Het sociale leven van weesolifanten is aanzienlijk veranderd door stroperij
- In populaties van microben, bio-ingenieurs vinden een balans tussen tegengestelde genomische krachten
- Onderzoekers ontwikkelen MRSA-dodende verf

- Defecten op nanoschaal vernietigen
- 3D-beelden van kleine objecten tot 25 nanometer

- Gigantisch piëzo-elektrisch effect om MEMS-apparaten te verbeteren
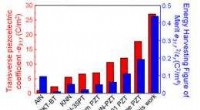
- Tweedimensionale atomair platte transistors zijn veelbelovend voor de volgende generatie groene elektronica

 Speekseleiwitten kunnen verklaren waarom sommige mensen te veel zout gebruiken
Speekseleiwitten kunnen verklaren waarom sommige mensen te veel zout gebruiken De postpandemische stad:expert over hoe het coronavirus toekomstige steden zal beïnvloeden
De postpandemische stad:expert over hoe het coronavirus toekomstige steden zal beïnvloeden Het is misschien tijd om na te denken over een cybernetische Bill of Rights
Het is misschien tijd om na te denken over een cybernetische Bill of Rights Welke invloed kunnen lawines op mensen hebben?
Welke invloed kunnen lawines op mensen hebben?  Geëlektrificeerde magneten:onderzoekers ontdekken een nieuwe manier om met gegevens om te gaan
Geëlektrificeerde magneten:onderzoekers ontdekken een nieuwe manier om met gegevens om te gaan Wetenschappers vinden veel hoger dan verwachte snelheid van smelten van gletsjers onder water
Wetenschappers vinden veel hoger dan verwachte snelheid van smelten van gletsjers onder water Thermische spinstromen bevestigd in zowel ruimte als tijd
Thermische spinstromen bevestigd in zowel ruimte als tijd Ontdekking kan leiden tot duurzame ethanol gemaakt van koolstofdioxide
Ontdekking kan leiden tot duurzame ethanol gemaakt van koolstofdioxide
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

