
Wetenschap
Vloeistofmuren rond levende cellen verhogen

Herconfigureren van patronen van de vloeistofwanden. Bekijk de volledige film op, Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav8002
Celkweekplaten die dagelijks in de biologie worden gebruikt, kunnen effectief worden omgezet in microfluïdische apparaten, wegen openen voor biologen om op cellen gebaseerde workflows te miniaturiseren. In een recent rapport, doctoraat onderzoeker Cristian Soitu en medewerkers van de afdelingen Ingenieurswetenschappen en Pathologie aan de Universiteit van Oxford, Oxford, VK, beschreef een eenvoudige methode om microfluïdische arrangementen rond cellen te creëren. In de studie, de cellen groeiden al op standaard petrischaaloppervlakken, toen de wetenschappers het grensvlak tussen de niet-mengbare vloeibare media in de container als bouwmateriaal gebruikten.
Ze hebben de conventionele celcultuurschalen op aanvraag omgebouwd tot geavanceerde microfluïdische apparaten door vloeibare structuren rond levende cellen te hervormen. Soitu beschrijft de nieuwe vloeistofvormende techniek die door zijn onderzoeksteam is gebouwd als "vloeibare structuren voor die cellen met angst voor binding bij het kiezen van een huis - ze kunnen gemakkelijk worden verwijderd en nieuwe (met een andere geometrie) worden gebouwd." Het onderzoek is nu gepubliceerd op wetenschappelijke vooruitgang
De onderzoekers demonstreerden de methode met behulp van workflows waarbij celklonen betrokken waren; selectief klonen van een specifieke kloon uit oa een schaaltje; medicamenteuze behandelingen; en wondgenezing. Het onderzoekswerk toonde een veelzijdige aanpak aan, gekoppeld aan biologisch vriendelijke eigenschappen om de microfluïdische technologie onder biologen te promoten. Op microfluïdica gebaseerde benaderingen zijn populair geworden in veel workflows, hoewel hun opname in de reguliere biologie traag blijft vanwege een verscheidenheid aan bijdragende redenen, inclusief:
- Materiële incompatibiliteit voor celgroei
- Microfluïdische architecturen die ingesloten en ontoegankelijk zijn
- Vooraf bepaalde geometrieën die niet opnieuw kunnen worden geconfigureerd tijdens experimenten, waardoor fabricage- en bedieningskosten ontstaan
- Workflows ontworpen door ingenieurs die niet aansluiten bij reeds bestaande technieken die zijn ontwikkeld door biologen.
Vroeger, wetenschappers creëerden 3D-constructies met vloeistofwanden op nanoschaal, hoewel hun biocompatibiliteit nog moet worden beoordeeld. In het huidige werk, daarom, Soitu et al. ontwikkelde een methode om arrays van geïsoleerde microfluïdische kamers op maagdelijke petrischalen te maken om grote workflows in celbiologie te accommoderen. Mogelijke voorbeelden zijn celvoeding en -overdracht, klonen, cryopreservatie, fixatie en immunolabeling, cellysis en reverse transcriptie polymerase kettingreactie (RT-PCR) en CRISPR-Cas9 genbewerking. In eerdere experimenten met dergelijke workflows hebben wetenschappers de cellen toegevoegd na de fabricage van microfluïdica.
In het huidige werk, de onderzoekers creëerden een verscheidenheid aan microfluïdische arrangementen op standaard petrischalen die hechtende cellen bevatten en herconfigureerden ze in realtime. Ze zijnoleerden en haalden celklonen terug om proof-of-concept drugtests en wondgenezingsassays uit te voeren en introduceerden de nieuwe techniek om microfluïdische circuits op petrischalen te creëren en opnieuw te configureren terwijl cellen groeiden en verdeelden, met veel potentiële toepassingen in de reguliere biologie.
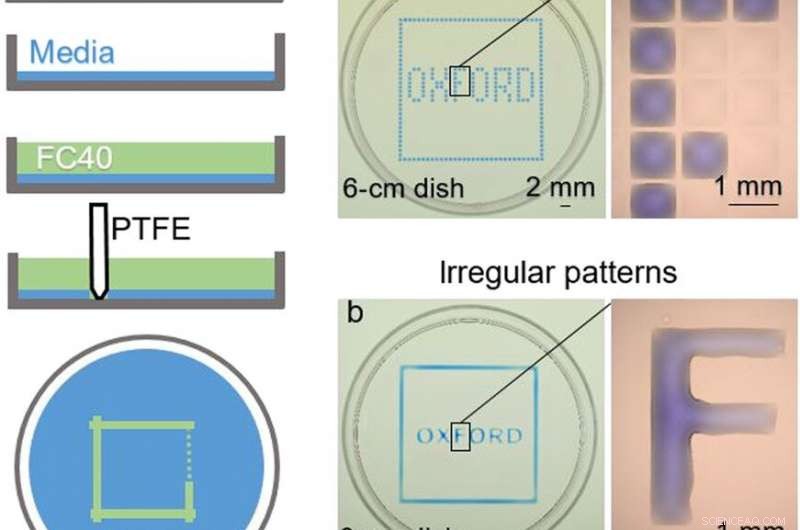
BOVEN:Kamerconstructie. (A) Principe. Dulbecco's gemodificeerd Eagle's medium (DMEM) + 10% foetaal runderserum (FBS) wordt toegevoegd aan een maagdelijk petrischaaltje, en het grootste deel van het medium wordt verwijderd om een dunne film achter te laten die de bodem bedekt, die is bedekt met FC40. De stylus wordt over de bodem verplaatst om een microfluïdische opstelling te creëren. Wanneer voltooid, het initiële volume van DMEM + 10% FBS wordt verdeeld in twee delen, gescheiden door een continue vloeistofwand van FC40 die op het substraat is vastgemaakt. (B) Verschillende patronen. (a) Door verticale en horizontale lijnen op gelijke afstand van elkaar te vormen, ontstaat een array (32 × 32; tussenruimte van 1 mm). Volgende, 60 nl blauwe kleurstof wordt door de printer aan geselecteerde kamers toegevoegd; perifere kamers krijgen blauwe kleurstof om het blauwe vierkant te geven, en interne geven het woord "OXFORD". De vergroting (rechts) toont individuele kamers zonder en met kleurstof. (b) Een soortgelijk patroon wordt gecreëerd door twee vierkanten te vormen (de ene iets groter dan de andere) met de stylus en vervolgens handmatig kleurstof toe te voegen aan de ruimte ertussen; elke letter wordt gemaakt door de zijkanten te vormen en opnieuw handmatig het interieur te vullen. De vergroting laat zien dat de letter "F" één continue vloeistofmassa is. Fotocredit:Cristian Soitu, Universiteit van Oxford. BOTTOM:Herconfiguratie van microfluïdische arrangementen. Afbeeldingen tonen frames uit de film. (1) Er wordt een eerste patroon afgedrukt:een cirkel (straal, 1,5 mm) in een driehoek (zijde, 7 mm) binnen een vierkant (zijde, 9mm). (2 tot 4) Aan elk compartiment worden verschillende kleurstoffen toegevoegd (1,5 μl rode kleurstof, 1,5 μl gele kleurstof, en 5 ul blauwe kleurstof); kleurstoffen zijn opgesloten binnen FC40-muren. (5) Er wordt meer gele kleurstof aan de cirkel toegevoegd. (6) Na toevoeging van 3 μl gele kleurstof, de cirkelvormige speldlijn scheurt en de inhoud stroomt in de driehoek. (7) Na toevoeging van 24 l, de driehoekige speldlijn breekt en de inhoud stroomt het plein in. (8) Er wordt zestig microliter uit het vierkant gehaald. (9) Er wordt een nieuw patroon afgedrukt:een driehoek (zijde, 4,5 mm) in een cirkel (straal, 3,3 mm)—in het beginvierkant. (10 tot 12) Gekleurde kleurstoffen worden zoals voorheen aan de drie verschillende compartimenten toegevoegd. Fotocredit:Cristian Soitu, Universiteit van Oxford. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav8002
De nieuwe techniek en de proof-of-concept experimenten
In de experimenten die volgden, de onderzoekers bedekten eerst de bodem van een petrischaal met weefselkweekmedium en verwijderden het grootste deel van het medium om een dunne film te vormen die het polystyreensubstraat bedekte. Ze bedekten de dunne film met een onmengbare fluorkoolstof (FC40) om verdamping te voorkomen en als een barrière tegen externe verontreinigingen om de steriliteit van het medium te behouden. Gebruik vervolgens een Teflon-tip, de onderzoekers maakten contact met de bodem van de schaal, het verplaatsen van de waterige fase om microfluïdische arrangementen te vormen in de vorm van interesse - in dit geval een vierkant. Met behulp van de techniek, de onderzoekers brachten de voordelen van het open microfluïdische platform naar standaard celcultuur-ware.
Soitu et al. vormde de waterige fase om een raster te creëren met kleine hoeveelheden vloeistof zoals eerder aangetoond door hetzelfde team, en bekeken ze met selectieve kleurstoffen in selectieve kamers. Bijvoorbeeld, de perifere kamers kregen een blauwe kleurstof (die een blauw vierkant vormde) en die in de binnenste vormden het woord "OXFORD".

Het creëren van kamers voor de isolatie van celklonen. Bekijk de volledige film op, Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav8002
De onderzoekers "drukten" een cirkel in een driehoek binnen een vierkant en gebruikten microliters van drie kleurstoffen om de drie vormen afzonderlijk te bekijken; waar FC40 verhinderde dat de kleurstoffen zich mengden. De resultaten toonden de mogelijkheid om FC40-wanden te bouwen en te vernietigen om de vloeistoffen effectief in elke gewenste 2D-vorm op te sluiten.
Na de voorlopige proof-of-concept resultaten, Soitu et al. gegenereerde reeksen kamers om het klonen van borsttumorcellen van muizen (NM18) te recapituleren, waarvoor ze aanvankelijk rasters maakten, gevolgd door celtoevoeging daarna. De onderzoekers lieten de cellen eerst vrij groeien, omringd door de FC40-wand die doorlaatbaar is voor zowel O 2 en co 2 , en vervolgens door afzonderlijke cellen tot klonen te laten groeien voordat ze worden omgeven met vloeibare wanden van verschillende vormen.
Ze toonden aan dat vloeistofwanden met verschillende 2D-voetafdrukken gemakkelijk rond levende cellen kunnen worden gebouwd, zolang de kolonies tijdens de daaropvolgende behandeling of het ophalen van elkaar geïsoleerd bleven. Eerdere studies die cellen binnen beperkte, voorgevormde oppervlakken vereisten een oppervlaktebehandeling voorafgaand aan celadhesie, wat bijdroeg aan de opmerkelijke uitzondering in de huidige techniek.
Toepassingen bij het plukken van klonen en het testen van medicijnen
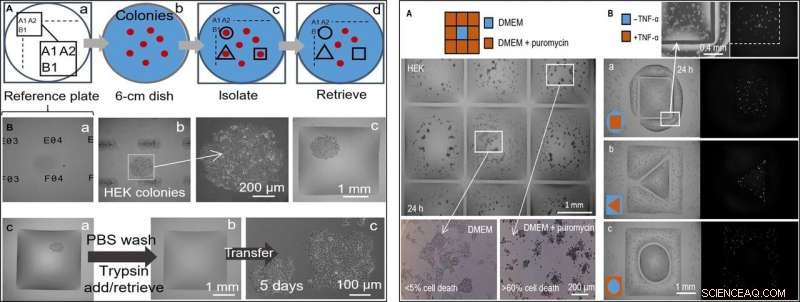
LINKS:Semi-automatisch selectief klonen plukken (HEK-cellen). De printer voegt in verschillende stadia een microliter toe aan/uit kamers. (A) Benadering. (a) Locaties op een glazen "referentieplaat" zijn gemarkeerd met unieke identificatiecodes (d.w.z. A1, A2 …, B1…). (b) Een 6-cm schaal met kolonies (rood) wordt op de referentieplaat geplaatst. (c) Na het opnemen van kolonielocaties en het invoeren ervan in een script, vloeiende muren worden afgedrukt rond geselecteerde klonen (zwarte lijnen). (d) Klonen worden uit deze kamers gehaald. (B) Isoleren van een kloon. HEK-cellen werden uitgeplaat bij lage dichtheid (~ 1 cel/cm2) en gekweekt (8 dagen) tot klonen, het gerecht werd op een referentieplaat geplaatst, en muren werden gebouwd rond geselecteerde klonen. Drie verschillende z-as aanzichten van één kloon worden getoond. (a) Referentieplaat met unieke identifiers in focus. (b) Kolonie in focus (identifiers onscherp) met vergroting. (c) Kolonie na het bouwen van omringende muren. (C) Kloon plukken. (a) Vierkante muur gebouwd rond één levende kolonie. De printer wast cellen door 1 l PBS toe te voegen/op te halen; het voegt dan 1 l trypsine toe. (b) De schaal wordt geïncubeerd (37 ° C; 5 min) om cellen los te maken van het oppervlak, en de printer haalt 1 l met de celrijke suspensie op (en brengt deze over naar een microcentrifugebuis) om de nu lege kamer te verlaten. (c) Teruggewonnen cellen worden handmatig uitgeplaat in een microtiterplaat met 12 putjes en 5 dagen conventioneel gekweekt; cellen hechten en groeien. RECHTS:Twee medicamenteuze behandelingen naast onbehandelde cellen. Rondom HEK-cellen (300, 000 cellen; schaal van 6 cm) gedurende 24 uur gekweekt. (A) Puromycin (3 × 3 raster; 2 mm × 2 mm kamers). De printer voegt 1 l medium toe aan de centrale kamer en 1 μl medium + puromycine aan perifere (eindconcentratie, 10 g/ml), zoals aangegeven in de cartoon. De levensvatbaarheid van de cellen wordt beoordeeld na incubatie (37°; 24 uur) met behulp van een trypaanblauw-exclusietest. Cellen in de buitenste kamers zijn dood (meer dan 60% in elk), terwijl die in de centrale in leven blijven (minder dan 5% celdood). Deze test is drie keer herhaald. (B) TNF-a. Paren kamers met verschillende vormen zijn bedrukt, de een om de ander heen. De printer voegt 0,5 μl medium ± TNF-α (eindconcentratie, 10 ng/ml) op een of ander volume (zoals in tekenfilms). Omdat cellen coderen voor een GFP-reportergen dat wordt gecontroleerd door een promotor die is ingeschakeld door TNF-α, ze fluoresceren groen bij blootstelling aan het cytokine. Fluorescentiebeelden laten zien dat alleen cellen in het behandelde volume groen fluoresceren. Volumeparen hadden de volgende afmetingen:(a) vierkant (zijde, 1,8 mm) in cirkel (straal, 1,75 mm); (b) driehoek (zijde, 1 mm) in vierkant (zijde, 3,5 mm); (c) cirkel (straal, 1 mm) in vierkant (zijde, 3,5mm). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav8002
In de volgende stap, de onderzoekers creëerden een referentieplaat waarop ze een schaal met interessante levende celkolonies plaatsten om celklonen van anderen te isoleren door vloeistofwanden om hen heen te printen. over isolatie, ze konden de kolonies kiezen, herstel de cellen en laat ze conventioneel groeien om zich zoals verwacht te vermenigvuldigen. Omdat de vloeistofwanden de vloeistoffen effectief konden opsluiten, Soitu et al. testten hun efficiëntie door puromycine toe te voegen - een vertaler-remmer met kleine moleculen die zoogdiercellen doodt.
In de experimentele opstelling voor drugsscreening, ze lieten de centrale kamer alleen groeimedium ontvangen, terwijl het medicijn in een hoge dodelijke dosis in de omliggende kamers werd afgeleverd, om de werkzaamheid van FC40-scheiding aan te tonen wanneer alleen de cellijnen in de centrale kamer overleefden. In een tweede voorbeeld Soitu et al. exploiteerde de eigenschap van een menselijke embryonale niercellijn die genetisch gemodificeerd was om te coderen voor een groen fluorescerend promotorgen. Die in aanwezigheid van tumornecrosefactor-α aanging om groen te fluoresceren. De vloeistofwanden vormden een effectieve barrière tegen blootstelling aan geneesmiddelen, het verifiëren van het potentieel van de drugscreening van de techniek.
Toepassingen bij wondgenezing
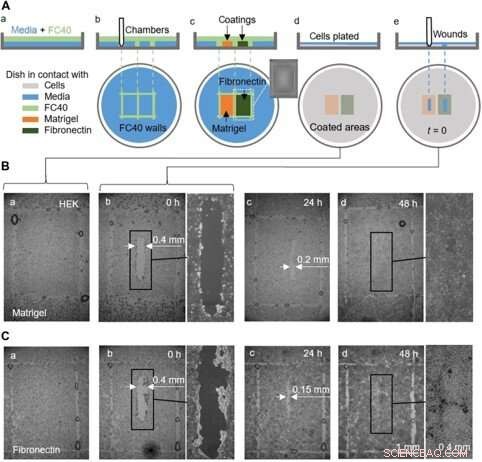
Een proof-of-concept wondgenezingstest met behulp van een schaal die vooraf is gecoat met Matrigel en fibronectine in verschillende regio's. (A) Cartoon ter illustratie van de workflow. (a) Een dunne laag medium wordt bedekt met FC40. (b) Twee kamers (elk 3 mm × 4 mm) worden naast elkaar afgedrukt. (c) Oppervlakken in kamers worden gecoat met Matrigel of fibronectine (2 l; eindconcentratie van 1 g/cm2; 1 uur); de inzet toont een afbeelding van één kamer. Vloeistofmuren zijn nu vernietigd, en de schaal wordt gewassen met 3 ml medium om niet-gehechte coatings te verwijderen. (d) HEK-cellen (600, 000) zijn uitgeplaat in de schaal. (e) Na 24 uur, cellen hebben een monolaag gevormd, en een wond (0,4 mm × 2 mm) wordt gemaakt door de stylus over het oppervlak te schrapen om cellen op zijn pad te verwijderen. Genezing van de wond wordt nu microscopisch gevolgd. (B en C) Afbeeldingen van wonden in monolagen gekweekt op Matrigel of fibronectine. (a en b) Onmiddellijk voor en na verwonding (er blijven enkele druppels FC40 achter op de plaats waar de muren oorspronkelijk stonden). (c) Na 24 uur, celgroei vermindert de wondbreedte tot <0,2 mm en <0,15 mm met Matrigel en fibronectine, respectievelijk. (d) Binnen 48 uur, wonden zijn volledig genezen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav8002
Ze voltooiden ook proof-of-principle-tests voor wondgenezing door een enkel schaaltje te gebruiken dat op twee verschillende manieren was gecoat, om twee wondgenezingsomstandigheden te controleren. Voor deze, de onderzoekers gebruikten Matrigel - een gelatineus eiwit dat wordt uitgescheiden door sarcoomcellen en fibronectine - een glycoproteïne van de extracellulaire matrix die de wondgenezing verbeterde. Ze voegden HEK-cellen toe die een monolaag in de schalen vormden en creëerden een "wond" door de teflontip over de monolaag te slepen wanneer cellen met enigszins verschillende snelheden in de wonden migreerden. Hoewel in deze workflow Soitu et al. pre-coated het oppervlak voordat de cellen worden geplateerd, ze konden ook de coatingtechniek aanpassen voor de toevoeging ervan nadat de cellen begonnen te migreren naar de nieuw gevormde wonden om genezing te bevorderen.
Op deze manier, Cristian Soitu en medewerkers ontwikkelden een flexibele, microfluïdisch platform om workflows in celbiologie te miniaturiseren. Ze breidden de techniek in het huidige werk uit om microfluïdische arrangementen rond voorgeplateerde hechtende cellen te vormen, gevolgd door een verscheidenheid aan proof-of-principle-assays op celklonen, screening van geneesmiddelen en wondgenezing. Het platform heeft veel voordelen en kan de conventionele modus van vooraf ontworpen microfluïdische apparaten vervangen als een flexibel en aanpasbaar alternatief. De nieuwe microfluïdische arrangementen zijn kosteneffectief en dragen bij aan de zuinige wetenschap en kunnen tijdens een experiment in realtime opnieuw worden geconfigureerd voor extra veelzijdigheid. De onderzoekers merken beperkingen van de techniek op, inclusief 2-D beperkte opstellingen en de kwetsbaarheid van vloeibare muren in vergelijking met massieve muren. Soitu et al. hopen deze functies en voordelen te optimaliseren en te combineren om een nieuw platform te bieden voor reguliere biologen om de kracht van microfluïdica te verkennen.
© 2019 Wetenschap X Netwerk
 Yellowstone supervulkaan heeft een andere geschiedenis dan eerder werd gedacht
Yellowstone supervulkaan heeft een andere geschiedenis dan eerder werd gedacht Geowetenschappers creëren een diepere kijk op processen onder het aardoppervlak met 3D-beelden
Geowetenschappers creëren een diepere kijk op processen onder het aardoppervlak met 3D-beelden Meteoriet bevat het oudste materiaal op aarde:7 miljard jaar oud sterrenstof
Meteoriet bevat het oudste materiaal op aarde:7 miljard jaar oud sterrenstof Een gladde helling:hoe klimaatverandering het arctische landschap verandert
Een gladde helling:hoe klimaatverandering het arctische landschap verandert Nederland zet gas uit aardbevingsgebied uit voor 200 bedrijven
Nederland zet gas uit aardbevingsgebied uit voor 200 bedrijven
Hoofdlijnen
- Overlevingsstrategie van boodschapper-RNA's tijdens cellulair suikertekort
- Beschrijving van gen-splitsing als een DNA-techniek
- Ryk heeft een begeleider nodig
- Illinois sportvis herstel een resultaat van 1972 Clean Water Act, wetenschappers rapporteren
- Wat zijn de twee hoofdfasen van de celcyclus?
- Producten geproduceerd door Anaerobe ademhaling
- Cheerleading Science Fair Projectideeën
- Instrumenten gebruikt in de biologie
Biologen en biologiestudenten gebruiken verschillende instrumenten in hun werk om kennis over levende wezens te verzamelen. Deze instrumenten en hulpmiddelen worden elk jaar gedetailleerder en hightech, evenals
- Inzoomen op eiwit om nierstenen te voorkomen
- 3D-printen op micrometerschaal

- Wetenschappers synthetiseren nieuwe nanodraden om snelle communicatie te verbeteren

- Van katalysatoren en chiraliteit:zeer selectieve groei van structuurspecifieke enkelwandige koolstofnanobuizen

- Om betere brandstofcellen te maken, bestudeer de gebreken
- Biofotonica-methode kan leiden tot identificatie van onstabiele plaques
 Coatings voor splijtstof om explosies in reactoren te voorkomen
Coatings voor splijtstof om explosies in reactoren te voorkomen De ruis in grafeen verlagen
De ruis in grafeen verlagen Journalistieke banen zijn precair, financieel onzeker en hulp van het gezin nodig
Journalistieke banen zijn precair, financieel onzeker en hulp van het gezin nodig Nieuwe en snellere methode om materiaaleigenschappen van grafeen te bepalen
Nieuwe en snellere methode om materiaaleigenschappen van grafeen te bepalen Met deze vier eenvoudige stappen kun je een rekenwonder worden
Met deze vier eenvoudige stappen kun je een rekenwonder worden De PKA in titratie
De PKA in titratie Beroemde theorie van de levende aarde geüpgraded naar Gaia 2.0
Beroemde theorie van de levende aarde geüpgraded naar Gaia 2.0 Niemand geeft om de standpunten van restaurants over dierenwelzijn, studie vondsten
Niemand geeft om de standpunten van restaurants over dierenwelzijn, studie vondsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

