
Wetenschap
Wetenschappers maken pakketten met genetische code van nanoformaat gericht op zaadcellen van hersenkanker
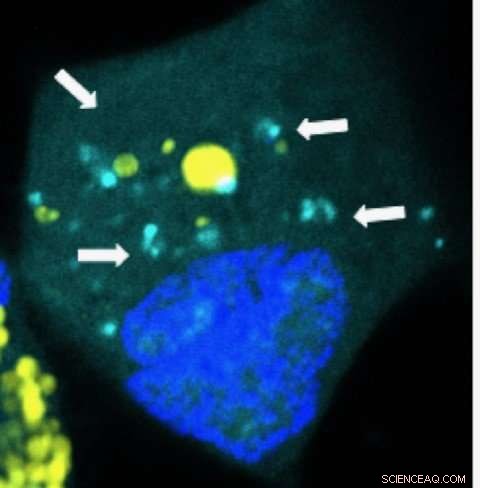
Nanodeeltjes die microRNA's (lichtblauw) vrijgeven in een menselijke hersenkankercel. Krediet:Yuan Rui, Johns Hopkins
In een "proof of concept"-studie, wetenschappers van Johns Hopkins Medicine zeggen dat ze met succes pakketten met genetische code van nanoformaat, microRNA's genaamd, hebben afgeleverd voor de behandeling van menselijke hersentumoren die in muizen zijn geïmplanteerd. De inhoud van de superkleine containers is ontworpen om kankerstamcellen aan te pakken, een soort cellulair "zaad" dat talloze nakomelingen voortbrengt en een meedogenloze barrière vormt om de hersenen van kwaadaardige cellen te bevrijden.
Resultaten van hun experimenten werden online gepubliceerd op 21 juni in Nano-letters .
"Hersenkanker is een van de meest algemeen begrepen kankers in termen van zijn genetische samenstelling, maar we moeten er nog een goede behandeling voor ontwikkelen, " zegt John Laterra, MD, doctoraat, hoogleraar neurologie, oncologie en neurowetenschappen aan de Johns Hopkins University School of Medicine en een onderzoekswetenschapper aan het Kennedy Krieger Institute. "De veerkracht van kankerstamcellen en de bloed-hersenbarrière zijn grote hindernissen."
Bloed dat de hersenen binnenkomt, wordt gefilterd door een reeks bloedvaten die als een beschermende barrière fungeren. Maar deze bloed-hersenbarrière blokkeert moleculaire medicijnen die het potentieel hebben om de therapie van hersenkanker te revolutioneren door zich te richten op kankerstamcellen, zegt Laterra.
"Om hersentumorbehandelingen te moderniseren, we hebben hulpmiddelen en methoden nodig die de bloed-hersenbarrière omzeilen, " zegt Jordan Groen, doctoraat, hoogleraar biomedische technologie, oogheelkunde, oncologie, neurochirurgie, materiaalwetenschap en techniek en chemische en biomoleculaire techniek aan de Johns Hopkins University School of Medicine. "We hebben technologie nodig om gevoelige genetische medicijnen veilig en effectief rechtstreeks aan tumoren te leveren zonder het normale weefsel te beschadigen."
Een voorbeeld, Groen zegt, is glioblastoom, de vorm van hersenkanker waar de senator John McCain van Arizona tegen vecht, waarvoor vaak herhaalde operaties nodig zijn. Artsen verwijderen het hersentumorweefsel dat ze kunnen zien, maar de maligniteit keert vaak snel terug, zegt Laterra. De meeste patiënten met glioblastoom leven minder dan twee jaar na de diagnose.
Wetenschappers vermoeden al lang dat kankerstamcellen de oorzaak zijn van de terugkeer en verspreiding van glioblastoom en andere vormen van kanker. Deze stamcellen geven aanleiding tot andere kankercellen en, als ze het mes van de chirurg ontwijken, kan leiden tot een geheel nieuwe tumor.
Later en Groen, die lid zijn van het Johns Hopkins Kimmel Cancer Center, ontwierp een manier om op efficiënte wijze superkleine pakketjes microRNA's af te leveren in gevestigde hersentumoren. De microRNA's richten zich op stamcellen van hersenkanker om hun vermogen om tumorgroei te verspreiden en te ondersteunen te stoppen.
De pakketten zijn gemaakt van biologisch afbreekbaar plastic, vergelijkbaar met materiaal dat wordt gebruikt voor chirurgische hechtingen en dat na verloop van tijd degradeert. ze zijn 1, 000 keer kleiner dan de breedte van een mensenhaar en typisch voor de grootte en vorm van natuurlijke componenten die cellen gebruiken om te communiceren. Wanneer kankercellen de pakketjes opslokken, ze breken uit elkaar en geven hun microRNA "payload" af, specifiek waar de microRNA's actie moeten ondernemen in de kankercellen.
In het nanopakket zitten microRNA's die specifiek binden aan boodschapper-RNA's die zijn gekoppeld aan twee genen:HMGA1 en DNMT, die samen functioneren om genexpressieprogramma's in cellen te reguleren.
Wanneer microRNA's binden aan deze boodschapper-RNA's, ze blokkeren hun vermogen om eiwitten te maken en schakelen programma's uit die de stamachtige kenmerken van de kankercellen aansturen. Zonder hun stengelachtige eigenschappen, de kankercellen zijn meer gedifferentieerd, ze verliezen hun vermogen om tumoren te verspreiden, en ze kunnen vatbaarder zijn voor straling en medicijnen.
Voor hun experimenten, de Johns Hopkins-wetenschappers implanteerden menselijke glioblastomacellen in 18 muizen. Om de klinische uitdaging van het behandelen van een bestaande tumor na te bootsen, de wetenschappers wachtten 45 dagen voordat ze de dieren behandelden om er zeker van te zijn dat ze goed gevormde tumoren hadden. De helft van de dieren kreeg infusies van de nanopakketten met actieve microRNA's rechtstreeks in hun hersentumoren, en de andere helft ontving nanopakketten met inactieve microRNA's. Om het effect van de nanodeeltjes te isoleren, de wetenschappers gebruikten muizen die werden gefokt zonder immuunsysteem T-cellen die zich richten op kankercellen.
Five of the nine mice receiving inactive microRNAs (controls) died within two months, and the rest of the control mice died within 90 days. Three of the nine mice receiving active microRNAs lasted up to 80 days, and six lived to 133 days. Those six were humanely euthanized, and isolated mouse brains were examined for the presence of tumors.
All of the control mice had large tumors in their brains when they died. Four of the mice that received active microRNAs and lived to 133 days had no tumors, and two had small ones.
Green says that many genetic medicines are designed to target one gene. The type of nanoparticles the Johns Hopkins team used in this study can encapsulate multiple types of microRNAs to target multiple gene networks.
When the brain cancer stem cells internalize the nanoparticle and transition to a non-stem-cell state, Laterra says, clinicians could exploit that condition, and give radiation or other drugs to kill the now-vulnerable cells.
Green says scientific teams elsewhere are developing microRNA packets using lipid-based materials, and some standard chemotherapy is delivered in a fatty nanoparticle called a liposome.
Green and Laterra say the nanoparticles in their study are able to permeate the entire tumor because rodent brains are small. mensen, with bigger brains, may need a pump and catheter to funnel nanoparticles throughout the brain.
The Johns Hopkins team is working to scale up development of its nanoparticles and standardize their stability and quality before applying for permission to begin clinical trials on people.
 Wat is het verschil tussen kelkbladen en bloemblaadjes?
Wat is het verschil tussen kelkbladen en bloemblaadjes?  Klimaatgevoelige eilandnaties roepen de wereld op om onze toekomst te redden
Klimaatgevoelige eilandnaties roepen de wereld op om onze toekomst te redden Ophoping van fracking afvalwater gevonden in zoetwatermosselenschelpen
Ophoping van fracking afvalwater gevonden in zoetwatermosselenschelpen Wetenschappers vinden hoge concentraties giftige fenyltinverbindingen in lokale Chinese witte dolfijnen en onvinnige bruinvissen
Wetenschappers vinden hoge concentraties giftige fenyltinverbindingen in lokale Chinese witte dolfijnen en onvinnige bruinvissen Landforms veroorzaakt door Plate Tectonics
Landforms veroorzaakt door Plate Tectonics
Hoofdlijnen
- Een sociaal controlesysteem garandeert de zuiverheid van embryonale stamcellen
- Wanneer treedt melkzuurfermentatie op?
- Is geluk besmettelijk?
- Twilight-truc:er is een nieuw type cel gevonden in het oog van een diepzeevis
- Onderzoekers ontdekken een nieuwe manier om door virussen veroorzaakte kankers te onderdrukken
- Ontdekkingen van donkere materie kunnen licht werpen op nieuwe behandelingen voor ziekten
- Muizen in sociale conflicten vertonen gedrag dat zich aan regels houdt
- Verschillende soorten cellulaire communicatie
- Kan iemand zich herinneren dat hij geboren is?
- Hydrogel onthoudt zijn vorm

- Gecontroleerd scheuren van dunne films kan goedkope nanopatroon-arrays maken voor zonnecellen en biomoleculaire detectie
- Silicium nanodeeltjes kunnen leiden tot een ultrasnelle volledig optische transistor

- Ingenieurs stellen zich een elektronische schakelaar voor van slechts drie atomen dik
- Vervuiling door nanopolitie

 Thomson Reuters kondigt 3, 200 banenverlies in twee jaar
Thomson Reuters kondigt 3, 200 banenverlies in twee jaar Science Fair Project on Clouds
Science Fair Project on Clouds Nanogeneeskunde:Quantum dots lijken veilig in baanbrekend onderzoek op primaten
Nanogeneeskunde:Quantum dots lijken veilig in baanbrekend onderzoek op primaten Chemie van sterren werpt nieuw licht op de Gaia Sausage
Chemie van sterren werpt nieuw licht op de Gaia Sausage Kwantumalgoritme kan AI helpen sneller te denken
Kwantumalgoritme kan AI helpen sneller te denken Driedaagse beeldvorming legt hi-res, filmische weergave van vliegenbrein (update)
Driedaagse beeldvorming legt hi-res, filmische weergave van vliegenbrein (update) $ 16 per maand streamingdienst Philo breidt uit naar Amazon Fire en Apple TV
$ 16 per maand streamingdienst Philo breidt uit naar Amazon Fire en Apple TV Super-nano-kunststofvezels aangeprezen voor IT van de volgende generatie
Super-nano-kunststofvezels aangeprezen voor IT van de volgende generatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

