
Wetenschap
Een licht schijnen op genregulatie
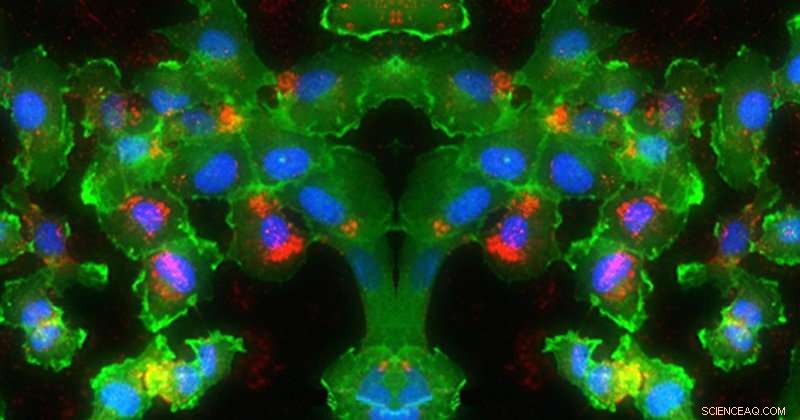
Op deze afbeelding, RNA (rood) wordt afgeleverd in de kernen (blauw) van cellen (groen). Krediet:Universiteit van Delaware, Evan Krape, Emily Day en Joy Smoker
Kankerbehandelingen - van bestraling tot chirurgie tot chemotherapie - zijn ontworpen om kankercellen te verwijderen of te doden, maar gezonde cellen worden daarbij vaak bijkomende schade. Wat als u lasers zou kunnen gebruiken om het behandelingsgebied te lokaliseren en medicijnen alleen aan kankercellen te leveren?
Een onderzoeksteam van de Universiteit van Delaware, geleid door Emily Day, een assistent-professor biomedische technologie, legt de basis voor een methode om kankerbevorderende genen in kankercellen te remmen en gezonde cellen intact te laten. In een nieuw artikel gepubliceerd in Nano-letters , onthult het team ongekende inzichten in deze veelbelovende methode, waarbij nanodeeltjes worden gecoat met genregulerende middelen en ze vervolgens worden blootgesteld aan een dosis laserlicht om dat materiaal te ontketenen.
Omdat de nanodeeltjes de genregulatoren inactief houden totdat hun afgifte on-demand met licht wordt geactiveerd, ze hebben een aanzienlijk potentieel om kankertherapie met hoge precisie mogelijk te maken, terwijl de impact op niet-bestraalde gezonde cellen wordt geminimaliseerd. Day en haar team testten hun nieuwe methode tegen hersentumorcellen door de nanodeeltjes te gebruiken om de expressie van groen fluorescerend eiwit (GFP) in de cellen tot zwijgen te brengen.
Een nieuwe manier om lasers en nanodeeltjes te combineren
Zoals scalpels en hechtingen, lasers worden vaak gebruikt in medische procedures. Oogartsen gebruiken lasers om hoornvliezen te hervormen bij oogcorrecties. Dermatologen gebruiken lasers om littekens op de huid te vervagen. Cardiologen gebruiken lasers om verstopte slagaders te openen. Oncologen gebruiken lasers om kankercellen en tumoren te vernietigen.
Het Day Lab wil lasers combineren met op licht reagerende genregulerende nanodeeltjes om kankercellen strategisch te vernietigen en nevenschade te minimaliseren.
Ze beginnen met kleine storende RNA's, bekend als siRNA's, Dit zijn moleculen die bestaan uit complementaire strengen RNA die de expressie van bepaalde genen in kankercellen kunnen verminderen. De siRNA's zijn gecoat op nanodeeltjes gemaakt van silica en goud, die kleiner zijn dan de breedte van een mensenhaar. Deze deeltjes beschermen de siRNA's totdat ze het gewenste behandelingsgebied bereiken. De vraag is:hoe laat je ze op precies de juiste plek los?
"Eerder, als mensen RNA met nanodeeltjes wilden afleveren, ze kunnen de nanodeeltjes bedekken met een polymeer of celpenetrerend peptide, een middel om celopname en -afgifte te vergemakkelijken, ' zei Day. 'Het probleem is dat die agenten niet specifiek zijn. Uiteindelijk krijg je genregulatie in alle cellen, niet alleen de kankercellen die je wilde targeten voor genregulatie."
Dat is waar de precisie van lasers om de hoek komt kijken.
"Door licht geactiveerde siRNA-afgifte stelt je in staat om genen alleen tot zwijgen te brengen waar de deeltjes en het licht worden gecombineerd, " zei Day. "Omdat jij kiest waar het licht gaat, en dus waar het siRNA wordt vrijgegeven, je kunt heel specifieke gen-uitschakeling in tumorcellen bereiken, het verminderen van het potentieel voor off-target effecten."
Voor deze experimenten is Day en haar team (onder leiding van de afstudeerstudente Rachel Riley van de afdeling Biomedische Technologie) stelden de met siRNA gecoate nanodeeltjes bloot aan continu golflicht of aan korte lichtpulsen die elke quadriljoenste van een seconde werden toegediend. Beide soorten bestraling veroorzaakten de afgifte van siRNA in dubbelstrengs en enkelstrengs vormen, wat als een verrassing kwam, aangezien eerdere studies in de wetenschappelijke literatuur suggereerden dat continue golfbestraling alleen enkele strengen siRNA zou vrijgeven (wat betekent dat de twee complementaire strengen van het siRNA van elkaar gescheiden, in plaats van dat de gehele duplex vrijkomt van het oppervlak van de nanodeeltjes).
"Dit is de eerste keer dat iemand heeft aangetoond dat je zowel siRNA-duplexen als enkele strengen RNA kunt laten vrijgeven uit nanodeeltjes met behulp van een continue golflaser als de excitatiebron, "zei Day. "Echter, onze studies laten ook zien dat gepulseerd licht veel efficiënter is in het vrijgeven van siRNA-duplexen dan continu-golflicht. Het is absoluut noodzakelijk dat er voornamelijk duplexen vrijkomen uit de nanodeeltjes, omdat alleen duplex-siRNA in cellen zal functioneren om de expressie van de beoogde genen tot zwijgen te brengen."
Dag vervolg, "Verder, onze studies tonen aan dat gepulseerd licht cellen niet opwarmt zoals continugolflicht. Dit is belangrijk omdat te veel warmte ervoor kan zorgen dat cellen worden beschadigd door andere mechanismen dan de gewenste genregulatie."
Haar laboratoriumgroep is goed toegerust om dergelijke inzichten met betrekking tot het mechanisme van door licht geactiveerde RNA-afgifte uit nanodeeltjes te ontdekken, omdat ze uniek interdisciplinair onderzoek uitvoeren.

Van links, Margaret Billingsley, Emily dag, en Rachel Riley werken aan een van hun eerdere onderzoeken, deze over kankerdetectie. Krediet:Universiteit van Delaware, Evan Krape, Emily Day en Joy Smoker
"Mijn lab heeft veel expertise in RNA-afgifte en kankerbiologie, dus we hebben veel meer vaardigheden op het gebied van moleculaire biologie dan een traditioneel laboratorium voor nanotechnologie, en dit stelt ons in staat om de functie van RNA-nanodragers met ongekend detail te bestuderen, " ze zei.
Het nieuwe inzicht dat Day's onderzoek werpt op het gebruik van continu golflicht versus gepulseerd licht voor geactiveerde siRNA-afgifte uit nanodeeltjes, is een belangrijke bijdrage aan het gebied van medicijnafgifte. Naast het aantonen van de functionele verschillen tussen de twee wijzen van lichtexcitatie, het team toonde ook aan dat siRNA dat vrijkomt uit nanodeeltjes bij blootstelling aan gepulseerd licht de expressie van het beoogde gen (groen fluorescerend eiwit) beter verminderde dan een in de handel verkrijgbaar materiaal dat vaak wordt gebruikt om siRNA in cellen af te leveren in laboratoriumexperimenten. Dit was een opwindende observatie die de potentiële impact van dit nieuwe systeem aantoonde.
Dit werk werd uitgevoerd in samenwerking met Lars Gundlach van de afdeling Scheikunde en Biochemie en de afdeling Natuur- en Sterrenkunde aan de UD, die eigenaar is van de gepulseerde laser die in deze experimenten wordt gebruikt. Er is veel meer onderzoek nodig voordat dit kan worden vertaald naar een levensvatbare behandeling voor kankerpatiënten.
Wat is het volgende?
"The next step would be to show that we can do this with a more functional and biologically relevant RNA cargo than the siRNA targeting green fluorescent protein that was used in this work, " Day said. "There are a lot of different genes that are known to control cancer growth, so we will deliver RNA that targets genes that we know to be important in tumor progression and see if we are delivering enough to have an impact."
The team is particularly interested in studying the delivery of siRNA targeting beta-catenin, which plays an important role in triple-negative breast cancer, and also the delivery of microRNA (which is similar to siRNA, but can regulate multiple genes simultaneously). Bijvoorbeeld, Day's team hopes to deliver miR-34a, which is considered a master regulator of gene expression in cancer.
In addition to Day and Gundlach, the paper's authors include Rachel Riley, a doctoral student in the Department of Biomedical Engineering; Megan Dang, a doctoral student in Department of Biomedical Engineering; Maggie Billingsley, a senior undergraduate student in the Department of Biomedical Engineering; Baxter Abraham, a doctoral student in the Department of Chemistry and Biochemistry.
Riley, who will soon begin work as a postdoctoral associate at the University of Pennsylvania, started graduate school at UD because she wanted to do science that could make a real impact on the medical field. After losing an aunt to cancer, she was especially motivated to put her talents toward research that could someday help patients.
"The Day Lab's idea of incorporating nanoparticles for specific delivery of therapeutic agents was a really unique approach, " ze zei.
Billingsley has done research in the Day Lab since her first year at UD and wrote three peer-reviewed papers based on her work in the group. In 2017, she was the first author on a paper published in PLOS One . Volgende, Billingsley will attend graduate school at the University of Pennsylvania, where she will study immunotherapy. (She and Riley, a duo Day calls a "dream team, " could likely work together in the future.)
"When interviewing with graduate schools, this experience with The Day Lab was the main thing that helped me stand out in interviews and also understand what I wanted out of graduate school, " Billingsley said. "I have had so many opportunities to go down my own path and also work with others on new methods, ideas, and areas of research."
This paper also gave Billingsley a taste of an important aspect of scientific discovery.
"We found some results that conflicted with literature, which was a new experience for me, " she said. "That was more exciting that just confirming what was expected."
Algemeen, Day and her team are excited to further pursue this technology to reveal its potential as a high precision cancer therapy.
 Digitaliseren en repliceren van de wereld van materialen
Digitaliseren en repliceren van de wereld van materialen Nieuwe moleculen om kosten te verlagen, milieu-impact van de winning van edele metalen
Nieuwe moleculen om kosten te verlagen, milieu-impact van de winning van edele metalen Chemici veranderen de richting van de Diels-Alder-reactie volledig
Chemici veranderen de richting van de Diels-Alder-reactie volledig Efficiënte katalysator ontwikkeld voor het produceren van pronucleotiden
Efficiënte katalysator ontwikkeld voor het produceren van pronucleotiden Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen
Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen
Hoofdlijnen
- De verschillen in broederlijke en vaderlijke tweelingen
- Wat gebeurt er met een dierlijke cel in een hypotone oplossing?
- Ervaren dieren geluk?
- Waarom zijn er geen zeeslangen in de Atlantische Oceaan?
- De Saguaro Cactus is een iconisch symbool van het Amerikaanse zuidwesten
- Er is een microklimaat nodig om een pinyonboom te laten groeien
- Tientallen nieuwe natuurcorridors geïdentificeerd voor Afrikaanse zoogdieren
- CMU-software assembleert RNA-transcripten nauwkeuriger
- Veel retailers in het Midwesten verkopen verkeerd gelabelde invasieve wijnstokken
- theoretisch, numerieke studie van grafeenplaten onthult eigenschappen die kunnen leiden tot nieuwe opto-elektrische apparaten

- Onderzoekers gebruiken nanodeeltjes om kanker te bestrijden

- Grafeenpapier dat zich kan gedragen als geanimeerde origami (met video)

- Kleine lasersensor verhoogt gevoeligheid voor bomdetectie
- Onderzoekers produceren ultralichte aerogel

 Twee overheidsmeldingen wijzen op kwetsbaarheden in apparaten voor hartproblemen
Twee overheidsmeldingen wijzen op kwetsbaarheden in apparaten voor hartproblemen Very Large Telescope ziet ster dansen rond superzwaar zwart gat bewijst Einstein gelijk
Very Large Telescope ziet ster dansen rond superzwaar zwart gat bewijst Einstein gelijk Geografen gebruiken big data om te voorspellen hoe helling de reissnelheid van mensen beïnvloedt
Geografen gebruiken big data om te voorspellen hoe helling de reissnelheid van mensen beïnvloedt Neurale netwerk dat potentiële medicijnen veilig vindt, kan grootschalige pooling van gevoelige gegevens aanmoedigen
Neurale netwerk dat potentiële medicijnen veilig vindt, kan grootschalige pooling van gevoelige gegevens aanmoedigen Organisch afval en insecten:diervoeder van de toekomst?
Organisch afval en insecten:diervoeder van de toekomst? Positieve feedback tussen Oost-Aziatische circulatie op de middelste breedtegraden en de temperatuur van het landoppervlak
Positieve feedback tussen Oost-Aziatische circulatie op de middelste breedtegraden en de temperatuur van het landoppervlak Tesla zegt autobrand in Shanghai veroorzaakt door defecte batterijmodule
Tesla zegt autobrand in Shanghai veroorzaakt door defecte batterijmodule Hersenfuncties nabootsen met grafeen-diamantverbindingen
Hersenfuncties nabootsen met grafeen-diamantverbindingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

