
Wetenschap
Snelle opname van kankermarkers zal helpen bij diagnose en behandeling
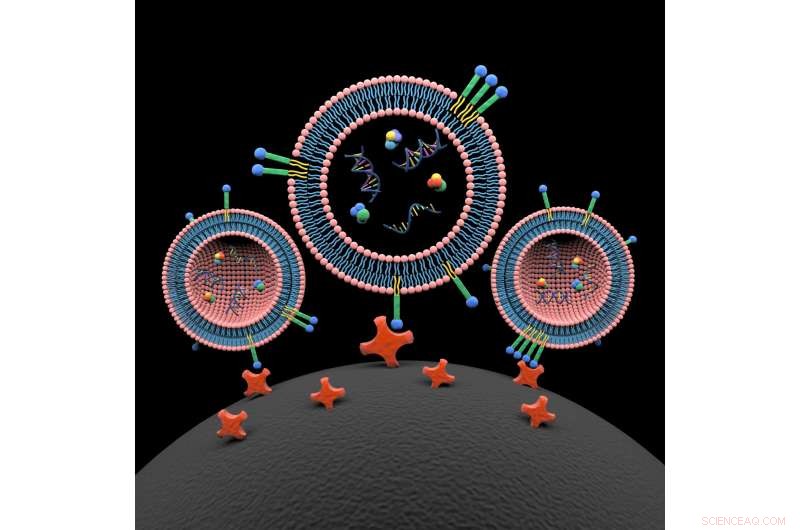
Lipide nanosondes (blauw, groen en geel gekleurd) spontaan invoegen in de lipide dubbellaag van drie extracellulaire blaasjes. De ladinginhoud van extracellulaire blaasjes omvat eiwitten, DNA en RNA. De met lipide nanosonde gelabelde extracellulaire blaasjes worden gevangen op het oppervlak van een magnetische kraal (zwart, onderaan) door interactie met geconjugeerde avidinemoleculen (rood). Exosoomisolatie en de ladinganalyse ervan bieden nieuwe mogelijkheden voor een breed scala aan moleculaire analyses, inclusief mutatiedetectie uit bloedplasma van kankerpatiënten. Krediet:Xin Zou/Penn State
Van een product op nanoschaal van menselijke cellen dat ooit als rommel werd beschouwd, is nu bekend dat het een belangrijke rol speelt in intercellulaire communicatie en in veel ziekteprocessen. inclusief kankermetastasen. Onderzoekers van Penn State hebben nanosondes ontwikkeld om deze zeldzame markers snel te isoleren. genaamd extracellulaire blaasjes (EV's), voor de mogelijke ontwikkeling van nauwkeurige kankerdiagnoses en gepersonaliseerde antikankerbehandelingen.
"De meeste cellen genereren en scheiden extracellulaire blaasjes af, " zegt Siyang Zheng, universitair hoofddocent biomedische technologie en elektrotechniek. "Maar ze zijn moeilijk voor ons om te bestuderen. Het zijn submicrometerdeeltjes, dus we hebben echt een elektronenmicroscoop nodig om ze te zien. Er zijn veel technische uitdagingen bij de isolatie van EV's op nanoschaal die we proberen te overwinnen voor point-of-care kankerdiagnostiek."
Eens, onderzoekers geloofden dat EV's niet veel meer waren dan vuilniszakken die door cellen werden weggegooid. Recenter, ze zijn gaan begrijpen dat deze kleine vetzakjes - lipiden - dubbelstrengs DNA bevatten, RNA en eiwitten die verantwoordelijk zijn voor de communicatie tussen cellen en markers kunnen dragen voor hun oorspronkelijke cellen, inclusief tumorcellen. In het geval van kanker, ten minste één functie voor EV's is om verre weefsels voor te bereiden op metastase.
De eerste uitdaging van het team was om een methode te ontwikkelen om EV's te isoleren en te zuiveren in bloedmonsters die meerdere andere componenten bevatten. Het gebruik van vloeibare biopsie, of bloedonderzoek, voor kankerdiagnose is een recente ontwikkeling die voordelen biedt ten opzichte van traditionele biopsie, waarbij een tumor moet worden verwijderd of een naald in een tumor moet worden gestoken om kankercellen te extraheren. Voor longkanker of hersenkanker, dergelijke invasieve technieken zijn moeilijk, duur en kan pijnlijk zijn.
"Niet-invasieve technieken zoals vloeibare biopsie hebben de voorkeur voor niet alleen detectie en ontdekking, maar ook voor het bewaken van de behandeling, " zegt Chandra Belani, hoogleraar geneeskunde en adjunct-directeur van het Kankerinstituut, Penn State College of Medicine, en klinisch medewerker aan het onderzoek.
"We hebben een systeem uitgevonden van twee micro/nano-materialen, " Zegt Zheng. "Een daarvan is een etiketteringsprobe met twee lipidestaarten die spontaan in het lipideoppervlak van het extracellulaire blaasje worden geplaatst. Aan het andere uiteinde van de sonde hebben we een biotinemolecuul dat wordt herkend door een avidinemolecuul dat we aan een magnetische kraal hebben bevestigd."
De aan het oppervlak gemodificeerde magnetische korrels hebben een diameter van 400 tot 500 nanometer en de labelingprobes zijn in de orde van grootte van 10 nanometer. Als het systeem is geoptimaliseerd, de onderzoekers kunnen de EV's in ongeveer 15 minuten isoleren uit bloedplasmamonsters. De EV's en hun inhoud kunnen vervolgens worden geanalyseerd in een laboratoriumomgeving of naar een commercieel diagnostisch laboratorium worden gestuurd om het DNA te karakteriseren, RNA en eiwitten.
In een artikel dat vandaag online is gepubliceerd, 10 april en als het omslagartikel voor april in Natuur Biomedische Technologie , hoofdauteur Yuan Wan, een postdoctoraal onderzoeker in het laboratorium van Zheng, beschrijft het gebruik van de nanosondes om EV's te vangen uit het bloedplasma van 19 patiënten met niet-kleincellige longkanker.
"Geholpen door deze nieuwe aanpak, we hebben met succes EV's geïsoleerd van 19 patiënten met gevorderde longkanker en DNA-mutaties geïdentificeerd die precisietherapie kunnen leiden in plaats van routinematige chemotherapie, ", zegt Wan. "Van het verzamelen van bloed tot het verkrijgen van EV-afgeleid DNA, de hele procedure kan binnen een uur worden voltooid. Het vereist alleen een magneet en een gewone tafelcentrifuge. Vergeleken met de gangbare methoden, het nanosondesysteem zou klinisch laboratoriumonderzoek aanzienlijk vergemakkelijken."
Omdat de technologie alleen materialen en een externe magneet nodig heeft, het is relatief goedkoop en snel in vergelijking met de huidige gouden standaard van scheiding, ultracentrifugatie genoemd, die dure apparatuur vereist en uren in beslag neemt.
Eenmaal gevalideerd in een grotere studie, Zheng en Belani geloven dat deze techniek niet alleen kan worden toegepast op longkanker, maar ook op de meeste, zo niet alle solide tumoren, die verantwoordelijk zijn voor 80-90 procent van de sterfgevallen door kanker.
"Sequencing van het DNA geïsoleerd uit de EV's zal dienen als een veelbelovend hulpmiddel om de evolutie van kanker te volgen en de tumordynamiek te volgen met als uiteindelijk doel de overleving van kanker te verbeteren, ’, besluit Belani.
 Wat gebeurt er met ionische en covalente verbindingen wanneer ze oplossen in water?
Wat gebeurt er met ionische en covalente verbindingen wanneer ze oplossen in water?  Team ontwikkelt snelle authenticatiemethode voor Chinese medicijnen
Team ontwikkelt snelle authenticatiemethode voor Chinese medicijnen NIST presenteert eerste real-world test van nieuwe sensorontwerpen voor schoorsteenemissies
NIST presenteert eerste real-world test van nieuwe sensorontwerpen voor schoorsteenemissies Anatomie van een acnebehandeling
Anatomie van een acnebehandeling Mangaan drukt zijn stempel op de synthese van geneesmiddelen
Mangaan drukt zijn stempel op de synthese van geneesmiddelen
 Antarctica registreert recordtemperatuur van meer dan 20 C
Antarctica registreert recordtemperatuur van meer dan 20 C Bewijs van zelfvormende watervallen gerapporteerd
Bewijs van zelfvormende watervallen gerapporteerd UTA civiel ingenieursboek illustreert de kracht van gerecycled plastic bij het versterken van wegen
UTA civiel ingenieursboek illustreert de kracht van gerecycled plastic bij het versterken van wegen Het verwarmen van ons klimaat schaadt onze economieën:studie onthult hogere kosten dan verwacht
Het verwarmen van ons klimaat schaadt onze economieën:studie onthult hogere kosten dan verwacht Opname van een gewasmodel in een klimaatmodel
Opname van een gewasmodel in een klimaatmodel
Hoofdlijnen
- Wetenschappers onthullen eiwitstructuur die cruciaal is voor genexpressie
- Luipaarden doden minstens 3 kinderen op het Indiase platteland
- Studie onderzoekt obesitas en reproductieve status van dierentuinolifanten
- Hoe maak je een 3D-tandmodel voor een schoolproject
- Hoe construeren wetenschappers recombinante DNA-moleculen?
- Onderzoekers ontdekten dat overmatige sociale interactie de collectieve respons verminderde
- Aanvallen van rupsen zorgen ervoor dat bladluizen planten kunnen besluipen
- Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?
- Enzymen: wat is het? & Hoe werkt het?
- 3D-printmethoden maken gefabriceerde nanofilms mogelijk met meerdere uitlijningsassen

- Een veelzijdige methode om gefunctionaliseerde nanodraden te modelleren
- Onderzoekers ontwikkelen batterijloze chemische detector

- Onderzoekers werpen licht op de bouwstenen voor LED-displays van de volgende generatie

- Doorbraak in de verwerking van nanobuisjes op industriële schaal

 Wachten op de volledige breuk
Wachten op de volledige breuk NICER-missie vindt een röntgenpulsar in een recordsnelle baan
NICER-missie vindt een röntgenpulsar in een recordsnelle baan Een model van een bidsprinkhaan maken
Een model van een bidsprinkhaan maken AI kan nu emoties lezen, maar zou dat ook moeten?
AI kan nu emoties lezen, maar zou dat ook moeten? Melkweg,
Melkweg,  Wat zijn de trofische niveaus in de savanne?
Wat zijn de trofische niveaus in de savanne?  Omgaan met stressvolle organisatieveranderingen
Omgaan met stressvolle organisatieveranderingen Onzichtbare kunststoffen in water
Onzichtbare kunststoffen in water
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

