
Wetenschap
Nieuw contrastmiddel op basis van nanodeeltjes dat pH-afhankelijk is
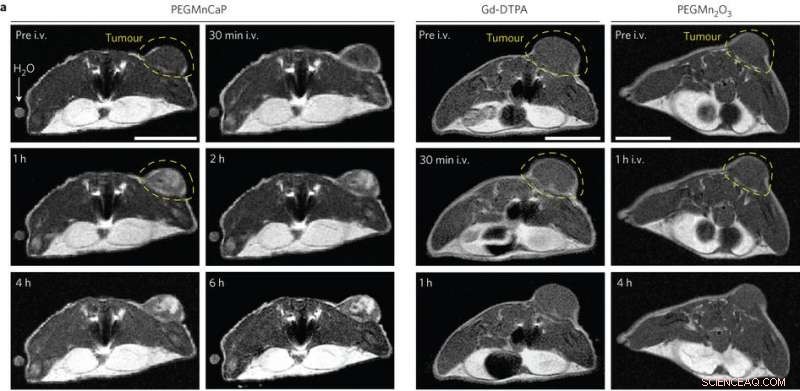
In vivo MR-beelden van subcutane C26-tumordragende muizen pre- en post-intraveneuze injectie (i.v.) van PEGMnCaP (links), Gd-DTPA (midden) en PEGMn2O3 (rechts) gemeten met 1 T MRI. Alleen PEGMnCaP vertoonde een selectieve en hoge verbetering van het tumorcontrast. Schaalbalk, 1 cm. Krediet:(c) Peng Mi et al, Natuur Nanotechnologie (2016). DOI:10.1038/nnano.2016.72
(Phys.org) - Een nieuw type MRI-contrastmiddel op basis van nanodeeltjes toont selectiviteit aan voor tumorcellen ten opzichte van niet-kankercellen, kan hypoxie detecteren, en is gevoelig genoeg voor de detectie van moeilijk te vinden kankercellen volgens een studie in Natuur Nanotechnologie .
Onderzoekers van de Universiteit van Tokio, Tokio Instituut voor Technologie, Kawasaki Institute of Industry Promotion, en het Japan Agency for Quantum and Radiological Science and Technology hebben een contrastmiddel ontwikkeld van op calciumfosfaat gebaseerde nanodeeltjes die een mangaanion afgeven in een zure omgeving. Het mangaanion bindt zich vervolgens aan eiwitten, waardoor een sterker contrastsignaal ontstaat dat langer aanhoudt dan de huidige klinisch goedgekeurde alternatieven. Deze op nanodeeltjes gebaseerde contrastmiddelen zijn ook gefunctionaliseerd met een poly(ethyleenglycol) omhulsel dat de hechting aan de kankercel bevordert.
Magnetische resonantiebeeldvorming is afhankelijk van de excitatie en daaropvolgende relaxatie van protonen. In klinische MRI-onderzoeken het signaal wordt bepaald door de relaxatietijd van de waterstofprotonen in water. Om een sterker signaal te krijgen, wetenschappers kunnen contrastmiddelen gebruiken om de relaxatietijd van de protonen te verkorten.
MRI is niet-invasief en omvat geen straling, waardoor het een veilig diagnostisch hulpmiddel wordt. Echter, het zwakke signaal maakt tumordetectie moeilijk. Het ideale contrastmiddel zou selecteren op kwaadaardige tumoren, waardoor de locatie en diagnose veel duidelijker worden.
Nanodeeltjescontrastmiddelen zijn interessant omdat nanodeeltjes kunnen worden gefunctionaliseerd en, zoals in deze studie, kan verschillende metalen bevatten. Onderzoekers hebben geprobeerd nanodeeltjes te functionaliseren met liganden die zich hechten aan chemische factoren op het oppervlak van kankercellen. Echter, kankercellen hebben de neiging om qua samenstelling heterogeen te zijn, wat ertoe leidde dat sommige onderzoekers op zoek gingen naar nanodeeltjes die reageren op verschillen in pH of redoxpotentiaal in vergelijking met normale cellen.
Peng Mi, Daisuke Kokuryo, Horacio Cabral, Hailiang Wu, Yasuko Terada, Tsuneo Saga, Ichio Aoki, Nobuhiro Nishiyama, en Kazunori Kataoka ontwikkelden een contrastmiddel dat bestaat uit Mn 2+ - gedoteerde CaP-nanodeeltjes met een PEG-omhulsel. Ze redeneerden dat het gebruik van CaP-nanodeeltjes, waarvan bekend is dat ze pH-gevoelig zijn, zou de gerichte vrijlating van Mn . mogelijk maken 2+ ionen in de micro-omgeving van de tumor. De micro-omgeving van de tumor heeft de neiging om een lagere pH te hebben dan de normale gebieden voor een snel celmetabolisme in een zuurstofarme omgeving. Mangaanionen werden getest omdat ze paramagnetisch zijn, wat zorgt voor een goed contrastmiddel. Ze binden ook aan eiwitten en creëren een langzaam roterend mangaan-eiwitsysteem dat resulteert in een scherpe contrastverbetering.
Studies met CaPMnPEG-nanodeeltjes toonden aan dat de nanodeeltjes stabiel zijn onder fysiologische omstandigheden (pH 7,4) en slechts 8% van de Mn 2+ Onder deze omstandigheden kwamen ionen vrij. In omstandigheden die de micro-omgeving van de tumor en de intercellulaire omgeving nabootsen, binnen vier uur 36% van de Mn 2+ ionen kwamen vrij bij pH 6,7, 71% bij pH 6,5, en meer dan 90% bij pH 5.
Aanvullend, testen met CaPMnPEG en humaan serumalbumine (HSA) in een zuur medium toonden significante signaalversterking. Dit komt door eiwitbinding van de Mn 2+ ion, die de moleculaire relaxiviteit van het ion aanzienlijk verhoogde.
Deze resultaten waren veelbelovend, dus Peng Mi, et al. vervolgens getest of het CaPMnPEG-contrastmiddel werkte in solide tumoren. Omdat Mn 2+ blijft opgesloten in de nanodeeltjesmatrix bij fysiologische pH, CaPMnPEG vertoont een veel lagere toxiciteit in vergelijking met MnCl 2 . MRI-onderzoeken toonden een tumor-naar-normaal contrast van 131% na 30 minuten, die veel hoger is dan Gd-DTPA, een klinisch goedgekeurd contrastmiddel. Na een uur, de tumor-tot-normaalverhouding was 160% en bleef enkele uren rond de 170%.
Driedimensionale MRI-onderzoeken van solide tumoren toonden aan dat zonder de toevoeging van CaPMnPEG, alleen bloedvaten waren zichtbaar. Echter, bij het toevoegen van CaPMnPEG, de tumor was gemakkelijk te onderscheiden. Aanvullend, er zijn aanwijzingen dat een teveel aan Mn 2+ verlaat het plasma na een uur. Het contrastsignaal bleef enkele uren sterk, wat aangeeft dat eiwitbinding in plaats van Mn 2+ concentratie is belangrijk voor signaalversterking.
Opmerkelijk, er waren helderdere contrastverhogende gebieden op de tumor. Aanvullende experimenten toonden aan dat regio's met een hoger contrast correleerden met tumorhypoxie. Kwaadaardige tumoren hebben de neiging hypoxisch te zijn, wat leidt tot een ophoping van lactaat. Dit resulteert in een verlaging van de pH. Andere technieken om hypoxie te detecteren hebben de neiging om alleen naar het oppervlak van het doelweefsel te kijken of, in het geval van PET, straling en een slechte resolutie met zich meebrengen. Deze techniek is veiliger, niet-invasief, en niet beperkt tot de oppervlaktetumoren.
Eindelijk, tests met uitgezaaide tumoren in de lever (C26-darmkankercellen) toonden aan dat CaPMnPEG goed werkt bij de analyse van vaste organen en zeer gevoelig is voor het detecteren van micrometastasen van millimeters. In tegenstelling tot andere contrastmiddelen die in de kliniek worden gebruikt, CaPMnPEG leverde een contrastsignaal dat enkele uren na injectie aanhield. Na een uur, het signaal werd met 25% versterkt en na twee uur, het signaal werd met 39% verbeterd.
Dit onderzoek rapporteert de ontwikkeling en karakterisering van een veelbelovend nieuw contrastmiddel dat een betere tumordetectie en -diagnose kan bieden. Aanvullende studies kunnen het testen van dit contrastmiddel omvatten met andere ziekten die fysiologische veranderingen in pH veroorzaken, evenals in vivo monitoring van nieuwe geneesmiddelen.
© 2016 Fys.org
 Molecuulstudies onthullen mogelijke behandeling voor patiënten met een beroerte
Molecuulstudies onthullen mogelijke behandeling voor patiënten met een beroerte Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen
Biochemici koppelen synthetische verbinding aan de productie van hongerhormonen Duurzaam zand haalt vervuilende stoffen uit regenwater
Duurzaam zand haalt vervuilende stoffen uit regenwater Wetenschappers vinden groene schat - zij het roestig - in de bodem
Wetenschappers vinden groene schat - zij het roestig - in de bodem De chemicaliën in zout, peper en suiker
De chemicaliën in zout, peper en suiker
 NASA's GPM vond dat Gert sterker werd tot een orkaan
NASA's GPM vond dat Gert sterker werd tot een orkaan Meer bomen zorgen niet altijd voor een koelere planeet, geograaf vindt
Meer bomen zorgen niet altijd voor een koelere planeet, geograaf vindt Wetenschappers pleiten voor langdurig onderzoek naar de verdeling van ozonbronnen
Wetenschappers pleiten voor langdurig onderzoek naar de verdeling van ozonbronnen Californias Kincade brandwond litteken gezien vanuit de ruimte
Californias Kincade brandwond litteken gezien vanuit de ruimte NASA-infraroodbeelden tonen windschering die tropische storm Maria beïnvloedt
NASA-infraroodbeelden tonen windschering die tropische storm Maria beïnvloedt
Hoofdlijnen
- Meelkracht om voedselzekerheid te vergroten
- Gouden aardappel levert een overvloed aan vitamine A en E
- Unieke manieren om een DNA-model te bouwen
- Tornado's Effecten op mensen
- De patronen van klimaatverandering
- UV-licht: positieve en negatieve effecten
- Enzymactiviteit in appels
- Zijn mannen gewelddadiger dan vrouwen?
- Kunnen planten denken?
- Nieuwe manieren verkennen om thermische straling te beheersen

- Waterstof oogsten uit nanotuinen
- Onderzoekers bereiken een nieuw niveau van duidelijkheid bij het opnemen van eiwitten die door lipiden bewegen

- Nieuw apparaat voedt draagbare sensoren door menselijke beweging
- Implanteerbare elektrodecoating zo goed als goud

 De langetermijneffecten van bosbranden
De langetermijneffecten van bosbranden Hoe doodskisten werken
Hoe doodskisten werken  Chemotherapie medicijnen reageren anders op straling in water
Chemotherapie medicijnen reageren anders op straling in water Een enkel foton onthult kwantumverstrengeling van 16 miljoen atomen
Een enkel foton onthult kwantumverstrengeling van 16 miljoen atomen Werkgevers aangespoord om nieuwe manieren te vinden om de geestelijke gezondheid van werknemers aan te pakken
Werkgevers aangespoord om nieuwe manieren te vinden om de geestelijke gezondheid van werknemers aan te pakken Laserverdampingstechnologie om nieuwe zonnematerialen te creëren
Laserverdampingstechnologie om nieuwe zonnematerialen te creëren NASA-team verkleint eeuwenoude technologie voor gebruik op CubeSats
NASA-team verkleint eeuwenoude technologie voor gebruik op CubeSats What Is a Solenoid?
What Is a Solenoid?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

