
Wetenschap
BPA afbreken met zichtbaar licht en een nieuwe hybride fotokatalysator
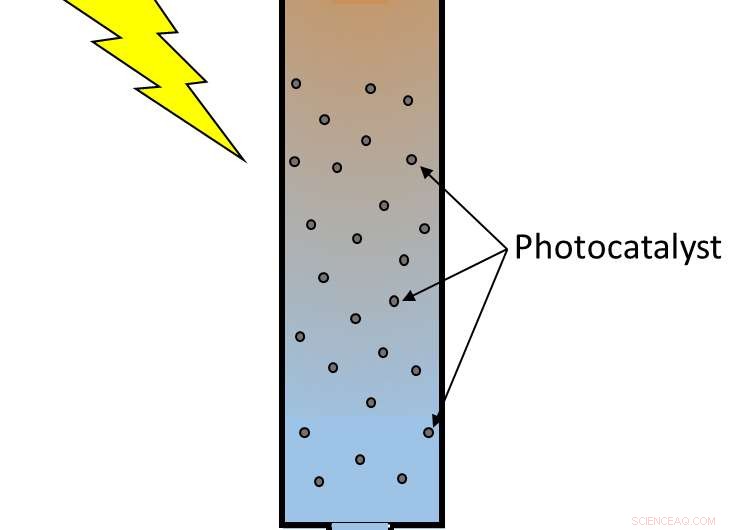
Het fotokatalytische nanomateriaal kan worden gebruikt om water te behandelen met zichtbaar licht. Krediet:D. Bahnemann/LUH Duitsland
In de loop van de laatste halve eeuw, BPA is van wonder naar bedreiging gegaan. Zijn populariteit steeg na de jaren vijftig, toen wetenschappers ontdekten dat het gebruikt kon worden om polycarbonaat plastic te maken - een harde, duurzaam, en transparant materiaal, perfect voor alles, van waterflessen tot medische apparaten.
Maar onlangs, dat stijgende succes is verzuurd:een groeiend aantal bewijzen suggereert dat zelfs lage doses BPA schadelijk kunnen zijn voor de gezondheid van mens en milieu. Het is geclassificeerd als een hormoonontregelende stof, een stof die de hormoonhuishouding van het lichaam kan doen ontsporen en mogelijk kanker of geboorteafwijkingen kan veroorzaken.
Veel fabrikanten schrappen BPA uit hun producten, met name opslagcontainers die worden gebruikt voor voedsel en dranken, maar het is nog steeds een enorme industrie. Verder, BPA wordt niet gemakkelijk afgebroken, waardoor het moeilijk is om het materiaal veilig weg te gooien. Als het in de waterwegen terechtkomt, het kan blijven bestaan als een milieutoxine.
Nutsvoorzieningen, onderzoekers hebben een nieuwe hybride fotokatalysator ontwikkeld die BPA kan afbreken met zichtbaar licht. Hun bevindingen, deze week gepubliceerd in het tijdschrift APL-materialen , van AIP Publishing, zou uiteindelijk kunnen worden gebruikt om watervoorraden te behandelen en om BPA en soortgelijke materialen veiliger te verwijderen.
Hoe de nieuwe katalysator werkt
Hun nieuwe materiaal breekt BPA af via fotokatalytische oxidatie, een proces waarbij licht een oxiderende chemische reactie activeert. Wanneer licht een fotokatalysator zoals titaniumdioxide (TiO2) nanodeeltjes raakt, de schok van energie kan een van zijn elektronen naar een aangeslagen toestand schoppen en een onbalans in de ladingsverdeling veroorzaken. In de hogere energie-elektronenband, er is nu een overmaat aan negatieve lading door de toevoeging van een elektron. In de tussentijd, in de elektronenband met lagere energie, er is een overmaat aan positieve lading (bekend als een "gat") omdat er een elektron is vertrokken. In deze opgewonden, onevenwichtige staat, TiO2 kan oxidatie en reductie van materialen eromheen katalyseren. Het aangeslagen elektron zal de neiging hebben om de TiO2 te verlaten om iets in de buurt te verminderen, terwijl het gat een andere stof zal helpen oxideren door een van zijn elektronen te accepteren.
Echter, pure TiO2 heeft een grote bandgap, dat wil zeggen het kost veel energie om elektronen van het ene niveau naar het andere te exciteren - en vertoont alleen fotokatalytische eigenschappen onder ultraviolet licht. Plus, het aangeslagen elektron heeft de neiging snel terug te vallen en te recombineren met het gat, waardoor de katalysator in zijn aangeslagen toestand weinig tijd heeft om een reactie op te wekken.
Om TiO2-nanodeeltjes om te zetten in een betere fotokatalysator, de onderzoekers hebben verschillende wijzigingen aangebracht. Eerst, ze voegden zilver toe aan het oppervlak van de nanodeeltjes, een veelgebruikte techniek om de ladingsscheiding te verbeteren. Wanneer licht op TiO2 valt en een van zijn elektronen opwekt, het zilver trekt dat elektron weg zodat het niet terug in het gat kan vallen. Het gat kan dan gemakkelijker helpen bij een oxidatiereactie.
De toevoeging van zilver veranderde ook de golflengte waarop de fotokatalysator werd geëxciteerd door gelokaliseerde oppervlakteplasmonresonantie-effecten te induceren - een fenomeen waarbij energetische elektronen aan het oppervlak van een materiaal met een specifieke frequentie trillen en de lichtabsorptie over een smal golflengtebereik verbeteren. In dit geval, het zilver verschoof de golflengte van het licht dat nodig was om de fotokatalysator te activeren naar het zichtbare lichtspectrum.
"De opname van een edelmetaal [zoals zilver] in het op ultraviolet reagerende TiO2 heeft het spectrum aanzienlijk uitgebreid naar het zichtbare licht door gelokaliseerde oppervlakte-plasmonresonantie-effecten, " zei Pichiah Saravanan, een onderzoeker van de Universiteit van Malaya die het project leidde.
Vervolgens, ze wikkelden de Ag/TiO2-nanodeeltjes in vellen gereduceerd grafeenoxide (RGO), een dunne laag koolstofatomen gerangschikt in een honingraatpatroon. Zoals het zilver, de toevoeging van RGO hielp het gat te volharden door geëxciteerde elektronen van TiO2 te accepteren. Het verkleinde ook de bandgap van de nanodeeltjes, het verminderen van de hoeveelheid energie die nodig is om de fotokatalysator te activeren.
Toen de onderzoekers de hybride nanodeeltjes mengden met BPA-oplossing onder een kunstmatige zichtbare lichtbron, ze ontdekten dat BPA veel effectiever oxideerde en afbrak dan zonder de aanwezige katalysator. Verder, de RGO-Ag-TiO2-nanodeeltjes presteerden beter dan die waarbij alleen RGO of Ag aan de TiO2 werden toegevoegd wat suggereert dat beide modificaties een rol speelden in de verhoogde katalytische activiteit onder zichtbaar licht.
Eventueel, het team hoopt hun bevindingen te gebruiken om BPA en andere verontreinigingen in watervoorzieningen af te breken. "We zijn er sterk van overtuigd dat de ontwikkelde nano-fotokatalysator een van de nanomaterialen kan zijn die dit probleem duurzaam kunnen aanpakken, ' zei Saravanan.
 De lucht blijft schoner omdat het verkeer na de lockdown weer normaal wordt, nieuw onderzoek suggereert:
De lucht blijft schoner omdat het verkeer na de lockdown weer normaal wordt, nieuw onderzoek suggereert: Afrikaanse regenwouden vertragen nog steeds de klimaatverandering ondanks recordhitte en droogte
Afrikaanse regenwouden vertragen nog steeds de klimaatverandering ondanks recordhitte en droogte NASA ziet Atlantische subtropische storm Melissa vormen voor de kust van New England
NASA ziet Atlantische subtropische storm Melissa vormen voor de kust van New England De soorten wilde katten in Massachusetts
De soorten wilde katten in Massachusetts  Japanse koolstofbelofte verhoogt de hoop van ammoniakdonateurs
Japanse koolstofbelofte verhoogt de hoop van ammoniakdonateurs
Hoofdlijnen
- Mendelian Vs. Moderne genetica
- Hoe huilen werkt
- Detectie van nieuwe eiwitten in actieve muizenhersenen
- Wat is een adaptief voordeel voor het beperken van DNA in een kern?
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
- De virale parasieten van gigantische virussen in de loop van de tijd volgen
- Hoe gendoping werkt
- Zes soorten neuroglia
- Opnieuw geïntroduceerde buideldieren kunnen een nieuwe bedreiging vormen voor op de grond levende vogels
- Grafeen en goud vormen een betere hersensonde
- Zwart-gatachtig effect in nanobuisjes en de mogelijkheid van nieuwe materietoestanden

- Gigantische vlokken maken grafeenoxidegel

- Antibioticaresistentie aanpakken:faag-nabootsende antibacteriële kern-schaal nanodeeltjes kunnen helpen
- Individuele atomen observeren in 3D-nanomaterialen en hun oppervlakken
 Zuinige energieopslag voor de elektrische auto van morgen
Zuinige energieopslag voor de elektrische auto van morgen Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen
Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen Egyptische archeologen vinden delen van farao's kraam
Egyptische archeologen vinden delen van farao's kraam Tot het maximum gekoesterd
Tot het maximum gekoesterd Nieuwe theorie ontdekt dat files in jetstream abnormale weerpatronen veroorzaken
Nieuwe theorie ontdekt dat files in jetstream abnormale weerpatronen veroorzaken Universum
Universum  Zorgprofessionals zijn belangrijke communicatoren bij het aanpakken van klimaatverandering
Zorgprofessionals zijn belangrijke communicatoren bij het aanpakken van klimaatverandering Moslim LGBTQI+ vluchtelingen hebben meer kans om asiel te krijgen in Duitsland als ze zich houden aan stereotypen, studie
Moslim LGBTQI+ vluchtelingen hebben meer kans om asiel te krijgen in Duitsland als ze zich houden aan stereotypen, studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

