
Wetenschap
Getransplanteerde cellen een nanotech-controle geven
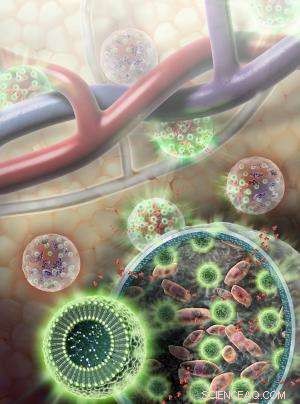
Nanosensoren (groene bollen) zijn samengesteld uit vet- en L-argininemoleculen, evenals afzonderlijke indicatormoleculen die MRI-detecteerbare en lichtsignalen afgeven wanneer cellen in leven zijn. Nanosensoren zijn ingesloten in een hydrogelmembraan samen met levercellen (roze). Voedingsstoffen en andere relatief kleine moleculen (rood) kunnen door het hydrogelmembraan van en naar de bloedbaan reizen. Krediet:Sayo Studios
Onderzoekers van Johns Hopkins hebben een manier bedacht om te detecteren of cellen die eerder in een levend dier zijn getransplanteerd, levend of dood zijn, een innovatie die volgens hen waarschijnlijk de ontwikkeling van celvervangende therapieën voor aandoeningen zoals leverfalen en type 1 diabetes zal versnellen. Zoals gemeld in het maartnummer van Natuurmaterialen , de studie gebruikte nanoschaal pH-sensoren en magnetische resonantiebeeldvorming (MRI) -machines om te bepalen of levercellen die in muizen werden geïnjecteerd, in de loop van de tijd overleefden.
"Deze technologie heeft het potentieel om van het menselijk lichaam minder een zwarte doos te maken en ons te vertellen of getransplanteerde cellen nog leven, " zegt Mike McMahon, doctoraat, een universitair hoofddocent radiologie aan de Johns Hopkins University School of Medicine die toezicht hield op de studie. "Die informatie zal van onschatbare waarde zijn bij het afstemmen van therapieën."
Vooruitgang in de regeneratieve geneeskunde is afhankelijk van betrouwbare middelen om beschadigde of ontbrekende cellen te vervangen, zoals het injecteren van pancreascellen bij mensen met diabetes van wie de eigen cellen niet genoeg insuline aanmaken. Om de getransplanteerde cellen te beschermen tegen het immuunsysteem, terwijl de vrije stroom van voedingsstoffen en insuline tussen de cellen en het lichaam mogelijk is, ze kunnen vóór transplantatie worden ingekapseld in squishy hydrogelmembranen. Maar, legt McMahon uit, "Als je de cellen eenmaal hebt geplaatst, je hebt echt geen idee hoe lang ze overleven." Dergelijke getransplanteerde cellen werken bij de meeste patiënten uiteindelijk niet meer, die insuline moet hervatten. Op dat punt, artsen kunnen alleen maar aannemen dat cellen zijn afgestorven, maar ze weten niet wanneer of waarom, zegt McMahon.
Met dat probleem in het achterhoofd, McMahons groep, die gespecialiseerd is in methoden voor het detecteren van chemische veranderingen, samengewerkt met de onderzoeksgroep onder leiding van Jeff Bulte, doctoraat, de directeur van cellulaire beeldvorming bij Hopkins' Institute for Cell Engineering. Bulte's groep bedenkt manieren om geïmplanteerde cellen door het lichaam te volgen met behulp van MRI. Onder leiding van onderzoekscollega Kannie Chan, doctoraat, het team bedacht een uiterst kleine, of nanoschaal, sensor gevuld met L-arginine, een voedingssupplement dat chemisch reageert op kleine veranderingen in zuurgraad (pH) veroorzaakt door de dood van nabijgelegen cellen. Veranderingen in de zuurgraad zouden op hun beurt veranderingen veroorzaken in sensormoleculen die zijn ingebed in de dunne laag vet die de buitenkant van het nanodeeltje vormt, een signaal afgeven dat met MRI kan worden gedetecteerd.
Om te testen hoe deze nanosensoren zouden werken in een levend lichaam, het team laadde ze in hydrogelbollen samen met levercellen - een mogelijke therapie voor patiënten met leverfalen - en een andere sensor die alleen bioluminescent licht afgeeft terwijl de cellen in leven zijn. De bolletjes werden net onder de huid van muizen geïnjecteerd. Zoals bevestigd door het lichtsignaal, de MRI detecteerde nauwkeurig waar de cellen zich in het lichaam bevonden en welk deel nog in leven was. (Dergelijke lichtindicatoren kunnen niet worden gebruikt om cellen bij mensen te volgen omdat ons lichaam te groot is om zichtbare signalen door te laten, maar met deze indicatoren kon het team controleren of de MRI-nanosensoren goed werkten in de muizen.)
"Het was opwindend om te zien dat dit zo goed werkt in een levend lichaam, " zegt Chan. Het team hoopt dat omdat de componenten van het systeem - hydrogelmembraan, vet moleculen, en L-arginine - zijn veilig voor mensen, het aanpassen van hun ontdekking voor klinisch gebruik zal relatief eenvoudig blijken te zijn. "Dit zou een groot deel van het giswerk uit celtransplantatie moeten wegnemen door artsen te laten zien of de cellen overleven, en zo niet, als ze sterven, "zegt Chan. "Op die manier kunnen ze erachter komen wat de cellen doodt, en hoe je dat kunt voorkomen."
Potentiële toepassingen van de sensoren zijn niet beperkt tot cellen in hydrogelcapsules, Bulte notities. "Deze nanodeeltjes zouden buiten capsules werken, en ze kunnen worden gecombineerd met veel verschillende soorten cellen. Bijvoorbeeld, ze kunnen worden gebruikt om te zien of tumorcellen sterven als reactie op chemotherapie, " hij zegt.
 Model koppelt patronen in sediment aan regen, stijging en zeespiegelverandering
Model koppelt patronen in sediment aan regen, stijging en zeespiegelverandering Cognitieve dissonantie:Canada roept een nationale klimaatnoodtoestand uit en keurt een pijpleiding goed
Cognitieve dissonantie:Canada roept een nationale klimaatnoodtoestand uit en keurt een pijpleiding goed Hawaï-lava kruist belangrijke snelweg, vernietigt elektriciteitspalen
Hawaï-lava kruist belangrijke snelweg, vernietigt elektriciteitspalen Alle dingen zullen ons overleven:hoe het inheemse concept van diepe tijd ons helpt de vernietiging van het milieu te begrijpen
Alle dingen zullen ons overleven:hoe het inheemse concept van diepe tijd ons helpt de vernietiging van het milieu te begrijpen In Vietnam, armoede en slechte ontwikkeling, niet alleen overstromingen, dood de meest gemarginaliseerden
In Vietnam, armoede en slechte ontwikkeling, niet alleen overstromingen, dood de meest gemarginaliseerden
Hoofdlijnen
- Hoge verwachtingen van Australische poging om pandawelpen te fokken
- Sint-jakobsschelpen hebben 200 ogen, die functioneren als een telescoop:studie
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Uitbreiding tonijnquota stap achteruit voor instandhouding
- Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van enzymactiviteit?
- Welke oorzaken smeren bij elektroforese?
- Wetenschappers werken aan een periodiek systeem voor ecologie
- Waarom vallen mensen steeds uit?
- Dominante fysische genen in Humans
- Metaalvrij gefluoreerd grafeen vertoont geen tekenen van toxiciteit in celkweektesten
- Laat er licht zijn:gecontroleerde creatie van kwantumemitterarrays

- Een nieuwe antivries- en anticondenscoating voor glas

- Nanoporeus grafeen kan beter presteren dan de beste commerciële waterontziltingstechnieken
- Chemici demonstreren legeringen op nanoschaal die zo helder zijn dat ze potentiële medische toepassingen kunnen hebben

 Bereid je voor op het ergste:10 stappen om je voor te bereiden op wildvuurrook
Bereid je voor op het ergste:10 stappen om je voor te bereiden op wildvuurrook NuSTAR onderzoekt raadselachtige fusie van sterrenstelsels
NuSTAR onderzoekt raadselachtige fusie van sterrenstelsels Minimale zuurstofconcentratie voor menselijke ademhaling
Minimale zuurstofconcentratie voor menselijke ademhaling Hoe hebben Watson en Crick baseparing bepaald?
Hoe hebben Watson en Crick baseparing bepaald?  Hoe het volume van een driehoek te berekenen
Hoe het volume van een driehoek te berekenen  Een diepzee-ecosysteem voeden:verrassend productieve microben zijn een belangrijke voedselbron in de afgrond
Een diepzee-ecosysteem voeden:verrassend productieve microben zijn een belangrijke voedselbron in de afgrond Waarom is de lucht blauw?
Waarom is de lucht blauw?  Supergeleidend metamateriaal vangt kwantumlicht op
Supergeleidend metamateriaal vangt kwantumlicht op
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

