
Wetenschap
Een klein, op silicium-zuurstof gebaseerd veelvlak komt de celkernen binnen om ze selectief op te lichten
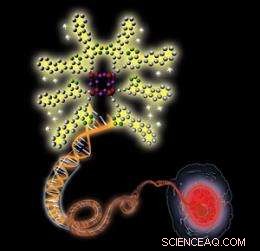
Schematische illustratie van een positief geladen nanoprobe (linksboven) die bindt aan een negatief geladen dubbelstrengs DNA-molecuul (midden), resulterend in verbeterde fluorescentie die de visualisatie van een cellulaire kern mogelijk maakt (rechtsonder). Krediet:Wiley-VCH 2010
Kernen zijn complex, goed gedefinieerde organellen die genetische informatie dragen die essentieel is voor de cel. Het visualiseren van deze organellen door middel van fluorescentiebeeldvormingstechnieken belooft de mechanismen te onthullen die genetische informatie regelen en manieren te bieden om genetische ziekten te voorspellen en te behandelen. In nauwe samenwerking met Xinhai Zhang van het A*STAR Institute of Materials Research and Engineering, een onderzoeksteam onder leiding van Bin Liu van de National University of Singapore heeft nu een methode ontwikkeld om ultrakleine, zeer selectieve fluorescerende nanosondes voor een cellulaire kernbeeldvormingstechniek die bekend staat als twee-foton-geëxciteerde fluorescentie (TPEF) microscopie.
Onderzoekers hebben een aantal fluorescerende stoffen voorgesteld om kernen in cellen te verlichten. Echter, door licht veroorzaakte verschijnselen, zoals cellulaire autofluorescentie en ernstige fotoschade, hebben de neiging om de prestaties van deze sondes te verminderen.
Bij de TPEF-techniek elke nanosonde produceert een fluorescerend signaal door niet één maar twee laagenergetische fotonen van nabij-infrarood licht te absorberen. Dit proces met twee fotonen vermindert de effecten van fotoschade en cellulaire autofluorescentie aanzienlijk, terwijl de resolutie wordt verbeterd, waardoor TPEF voordeliger is dan traditionele fluorescentiemicroscopie met één foton.
"TPEF-beeldvorming is krachtiger dan beeldvorming met één foton, in het bijzonder voor in vivo en weefselbeeldvorming waar sterke biologische autofluorescentie bestaat, ’ zegt Zhang.
In plaats van een traditionele stapsgewijze synthese, de onderzoekers kozen voor een 'bottom-up'-benadering om de nanosondes voor hun TPEF-schema te synthetiseren. Deze nanosondes bestaan uit kleine anorganische silicium-zuurstof kooien omgeven door korte positief geladen polymeerketens. Het team verkreeg aparte kooien en kettingen voordat ze ze samenvoegden, en de synthese leent zich goed voor het produceren van TPEF-nanosondes met verschillende lichtemissiekleuren en bio-herkenningsmogelijkheden.
De kleine, stijve kooien vergemakkelijken de opname van de sondes in cellulaire kernen, terwijl de positief geladen en lichtgevoelige ketens bijdragen aan de oplosbaarheid in water en optische eigenschappen. Volgens Liu, deze eigenschappen worden gecombineerd om uiteindelijk TPEF-geschikte oplichtende sondes te produceren.
Het team ontdekte dat de fluorescentie van de sondes aanzienlijk intenser werd bij blootstelling aan nucleïnezuren, zoals dubbelstrengs DNA en RNA. Dit komt omdat de positief geladen sondes stevig binden aan de negatief geladen nucleïnezuren door aantrekkelijke elektrostatische interacties, het verhogen van de micro-omgeving hydrofobiciteit van de sondes en hun fluorescentie. Verder, de sondes kleurden selectief de kernen van borstkanker en gezonde cellen met een lage toxiciteit.
De onderzoekers breiden momenteel hun sondeverzameling uit met andere intracellulaire doeltoepassingen. Ze optimaliseren ook de TPEF-prestaties van de sondes. "Deze nanosondes kunnen nieuwe manieren openen om biologische systemen op een contrastrijke en veilige manier te ondervragen, ’ zegt Zhang.
 Precisie-experimenten onthullen hiaten in de theorie van Van der Waals
Precisie-experimenten onthullen hiaten in de theorie van Van der Waals Kneusbare kunsthuid kan helpen bij protheses, robots voelen verwondingen
Kneusbare kunsthuid kan helpen bij protheses, robots voelen verwondingen Complexe objecten op cellulosebasis printen
Complexe objecten op cellulosebasis printen Smart label kan je op een dag laten weten wanneer je voedsel en cosmetica moet weggooien
Smart label kan je op een dag laten weten wanneer je voedsel en cosmetica moet weggooien Wat is een calorimeter en wat zijn de beperkingen?
Wat is een calorimeter en wat zijn de beperkingen?
 Hoe reproduceren lelieplanten?
Hoe reproduceren lelieplanten?  Zeebodemrobot breekt wereldrecord en onthult nieuwe gegevens voor modellering van klimaatverandering
Zeebodemrobot breekt wereldrecord en onthult nieuwe gegevens voor modellering van klimaatverandering Het binnenste van de aarde slikt meer koolstof op dan gedacht
Het binnenste van de aarde slikt meer koolstof op dan gedacht Hummingbird Nesting Habits
Hummingbird Nesting Habits  VK publiceert plannen om het vervoer tegen het midden van de eeuw koolstofarm te maken
VK publiceert plannen om het vervoer tegen het midden van de eeuw koolstofarm te maken
Hoofdlijnen
- Twilight-truc:er is een nieuw type cel gevonden in het oog van een diepzeevis
- Wat is het verschil tussen een protist en een menselijke huidcel?
- Waarom zijn botten belangrijk voor het lichaam?
- Hoe bouw je een DNA-model uit tandenstokers
- Goudvinken blijven jarenlang bij elkaar
- Teams Advance maakt het bewerken van genen met chirurgische precisie mogelijk
- Unieke manieren om een DNA-model te bouwen
- Een boom die zichzelf bezit, groeit in Athene,
- Profase: wat gebeurt er in dit stadium van mitose en meiose?
- Wetenschappers lossen tien jaar lang mysterie van nanopijlerformaties op

- Nanodeeltjestherapie kan kanker een dubbele klap geven
- Draagbaar nano-apparaat biedt snelle, nauwkeurige diagnose van tuberculose, andere bacteriële infecties
- Ingenieurs ontwerpen programmeerbare RNA-vaccins:tests bij muizen laten zien dat ze werken tegen ebola, influenza, en gewone parasiet
- Productielijn op nanoschaal voor de assemblage van biologische moleculen
 Mythen over vallende sterren
Mythen over vallende sterren  Welke soorten onzichtbare vlekken detecteren Black Lights?
Welke soorten onzichtbare vlekken detecteren Black Lights?  Een kunstmatig neuraal netwerk voegt zich bij de strijd tegen terugtrekkende gletsjers
Een kunstmatig neuraal netwerk voegt zich bij de strijd tegen terugtrekkende gletsjers Gletsjermuizen bewegen en dat heeft wetenschappers versteld doen staan
Gletsjermuizen bewegen en dat heeft wetenschappers versteld doen staan  Studie:afwegingen tussen reistijd, veiligheid
Studie:afwegingen tussen reistijd, veiligheid Natuurkundig principe verklaart orde en wanorde van zwermen
Natuurkundig principe verklaart orde en wanorde van zwermen Robots stappen op om die grote, slechte sintelblokken te verslaan
Robots stappen op om die grote, slechte sintelblokken te verslaan Astronomen onderzoeken open sterrenhoop NGC 6530
Astronomen onderzoeken open sterrenhoop NGC 6530
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

