
Wetenschap
Welke eigendom van water wordt tot zichzelf aangetrokken?
Dit is waarom:
* Watermoleculen zijn polair: Het zuurstofatoom in een watermolecuul heeft een enigszins negatieve lading, terwijl de waterstofatomen een enigszins positieve lading hebben. Dit creëert een dipoolmoment in het molecuul.
* Waterstofbindingen vormen zich: De enigszins positieve waterstofatomen in het ene watermolecuul worden aangetrokken door de enigszins negatieve zuurstofatomen in een ander watermolecuul. Deze aantrekkingskracht wordt een waterstofbinding genoemd.
* Sterke aantrekkingskracht: Waterstofbindingen zijn relatief sterk in vergelijking met andere intermoleculaire krachten. Dit betekent dat watermoleculen sterk tot elkaar worden aangetrokken.
Deze sterke aantrekkingskracht tussen watermoleculen is verantwoordelijk voor veel van de unieke eigenschappen van water, waaronder:
* Hoog kookpunt: Water heeft een hoger kookpunt dan veel andere vloeistoffen omdat er veel energie voor nodig is om de waterstofbruggen tussen de moleculen te verbreken.
* Hoge oppervlaktespanning: De sterke aantrekkingskracht tussen watermoleculen creëert een sterke oppervlaktespanning, waardoor water druppeltjes kan vormen en lichte objecten kan ondersteunen.
* Universeel oplosmiddel: Het vermogen van water om waterstofbruggen te vormen, kan het veel stoffen oplossen, waardoor het een uitstekend oplosmiddel is.
Laat het me weten als je nog andere vragen hebt!
 Hoe noemt u een oplossing waarin de maximale hoeveelheid oplosmiddel is opgelost, nog meer opgeloste opgeloste stof, zal als kristallen op de onderste container zitten?
Hoe noemt u een oplossing waarin de maximale hoeveelheid oplosmiddel is opgelost, nog meer opgeloste opgeloste stof, zal als kristallen op de onderste container zitten?  Het mechanisme van metaalextractie met ionische vloeistoffen bestuderen
Het mechanisme van metaalextractie met ionische vloeistoffen bestuderen Neutronen geven een nieuw beeld van thermische geleidbaarheid in complexe materialen
Neutronen geven een nieuw beeld van thermische geleidbaarheid in complexe materialen Moer en bout bestaande uit hetzelfde metaal hebben de voorkeur waarom?
Moer en bout bestaande uit hetzelfde metaal hebben de voorkeur waarom?  Eenkristallen diamant klaar maken voor elektronica
Eenkristallen diamant klaar maken voor elektronica
 Waarom werden konijnen uit de Nieuwe Wereld niet gedomesticeerd? Archeologen vinden het antwoord in het sociale gedrag van konijnen
Waarom werden konijnen uit de Nieuwe Wereld niet gedomesticeerd? Archeologen vinden het antwoord in het sociale gedrag van konijnen  Onze fouten toegeven:wanneer overtreft zelfacceptatie zelfvernietiging?
Onze fouten toegeven:wanneer overtreft zelfacceptatie zelfvernietiging?  Radicale heroverweging nodig om obesitas aan te pakken, honger, klimaat:rapport
Radicale heroverweging nodig om obesitas aan te pakken, honger, klimaat:rapport Technologie en natuur zijn historisch met elkaar verbonden
Technologie en natuur zijn historisch met elkaar verbonden Seismologen zien toekomst in glasvezelkabels als aardbevingssensoren
Seismologen zien toekomst in glasvezelkabels als aardbevingssensoren
Hoofdlijnen
- Wat is een organisme met twee allelen die precies hetzelfde worden genoemd?
- Waar verwijst de term homeostase naar?
- Onderzoek is baanbrekend in het begrijpen hoe een moleculaire motor kracht genereert
- Nieuwe slimme sensor om boeren te helpen kreupelheid bij schapen te herkennen
- Hebben plantencellen nucleaire membranen?
- Nieuw onderzoek laat zien hoe amyloïde bèta de hersencellen binnendringt
- Wat is een trangenisch organisme?
- Algen:biobrandstof van de toekomst?
- Eksters kunnen vriendschappen sluiten met mensen - dit is hoe
- Amerikaanse voorspellers:hier komt weer een heter dan normale zomer

- Afbeelding:Andros, Bahama's na orkaan Dorian

- Fracking leidt waarschijnlijk tot hoge emissies

- Olielozingen hebben de kust van Californië ontsierd en haar politiek gevormd

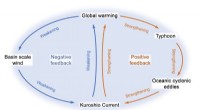
- Bewijs gevonden voor Kuroshio-stroomversterking door intensivering van tropische cyclonen
 Waarom natte objecten sneller drogen bij de bergtop.
Waarom natte objecten sneller drogen bij de bergtop.  Een benzineslurper besturen? U kunt de brandstofkosten nog steeds met bijna de helft verlagen
Een benzineslurper besturen? U kunt de brandstofkosten nog steeds met bijna de helft verlagen  Welke uitspraak verklaart het beste waarom een levend organisme in een natte omgeving binnen de veldzichtmicroscoop in en uit focus beweegt?
Welke uitspraak verklaart het beste waarom een levend organisme in een natte omgeving binnen de veldzichtmicroscoop in en uit focus beweegt?  Beweging van kleine waterdruppeltjes gecontroleerd door middel van een magneet
Beweging van kleine waterdruppeltjes gecontroleerd door middel van een magneet Wat is intermediair vochtvoedsel?
Wat is intermediair vochtvoedsel?  Wie concludeerde dat de aarde rond was?
Wie concludeerde dat de aarde rond was?  Wat is het gevaarlijkste type energie?
Wat is het gevaarlijkste type energie?  Welk proces vindt plaats binnen de mesofylcellen van blad?
Welk proces vindt plaats binnen de mesofylcellen van blad?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

