
Wetenschap
Waarom is de grootte van een elektronenspin groter dan het magnetische moment?
Dit is waarom:
* spin hoekmomentum: Elektronen hebben een intrinsieke eigenschap genaamd spin hoekmomentum, die wordt gekwantiseerd en aangeduid met het spin -kwantumnummer (s =1/2). Deze spin is analoog aan een elektronen die op zijn as draait, waardoor een magnetisch dipoolmoment ontstaat.
* Magnetisch dipoolmoment: Het magnetische dipoolmoment (µ) van een elektron is direct gerelateerd aan zijn spin hoekmomentum (s) door de volgende vergelijking:
µ =-g * e / (2m) * s
Waar:
* G is de G-factor (ongeveer 2 voor elektronen)
* e is de lading van een elektron
* M is de massa van een elektron
Daarom is de grootte van het magnetische moment recht evenredig met de grootte van het spinhoekmomentum.
Samenvattend is het magnetische moment van een elektron een direct gevolg van zijn spin en is niet groter dan de spin zelf. De twee zijn direct gerelateerd en hebben dezelfde eenheden (j/t of een m²).
Het is mogelijk dat de verwarring is ontstaan uit het verkeerd interpreteren van de eenheden of concepten.
 Gassen zijn de enige staat van materie dan kan?
Gassen zijn de enige staat van materie dan kan?  Kan een kernwapen de klimaatverandering tegengaan?
Kan een kernwapen de klimaatverandering tegengaan? Wat is onderscheidend elektron?
Wat is onderscheidend elektron?  Nieuwe methode voor het interpreteren van cryo-EM-kaarten maakt het gemakkelijker om eiwitstructuren te bepalen
Nieuwe methode voor het interpreteren van cryo-EM-kaarten maakt het gemakkelijker om eiwitstructuren te bepalen Honderd milliliter water kan 36 gram zout oplossen bij kamertemperatuur Hoeveel moet worden toegevoegd aan 25 ml dit voor de oplossing bereikt verzadiging?
Honderd milliliter water kan 36 gram zout oplossen bij kamertemperatuur Hoeveel moet worden toegevoegd aan 25 ml dit voor de oplossing bereikt verzadiging?
 Waarom we de bedreigde status van de Komodovaraan opnieuw moeten beoordelen
Waarom we de bedreigde status van de Komodovaraan opnieuw moeten beoordelen  De echte mislukking van de klimaatconferenties in Madrid was het niet krijgen van een brede deal over de wereldwijde koolstofmarkten
De echte mislukking van de klimaatconferenties in Madrid was het niet krijgen van een brede deal over de wereldwijde koolstofmarkten UITLEG:Hoeveel zal de regen de droogte in Californië helpen?
UITLEG:Hoeveel zal de regen de droogte in Californië helpen?  Stof uit de Sahara verstikt Zwitserland en Zuidoost-Frankrijk
Stof uit de Sahara verstikt Zwitserland en Zuidoost-Frankrijk  Snel smelten van 's werelds grootste ijsplaat gekoppeld aan zonnewarmte in de oceaan
Snel smelten van 's werelds grootste ijsplaat gekoppeld aan zonnewarmte in de oceaan
Hoofdlijnen
- Onderzoekers ontrafelen het mysterie van wervelende draaikolken in eicellen
- Wat is de complementaire basispaarregel?
- Waarom heeft het aërobe metabolisme een voordeel ten opzichte van het anaërobe metabolisme bij levende wezens?
- Onderzoeken hoe cellen met elkaar praten
- Bloei en mislukking:nieuw onderzoek laat precies zien hoe verschrikkelijk algen zijn voor de economie van Florida
- Gemakkelijke manieren om botten te herkennen in anatomie
- Waarom een strijkplaat gebruiken om bacteriën te laten groeien?
- Maak een lijst van twee organellen die plantencellen hebben, maar dieren niet?
- Wat is de definitie van een kern?
- Eigenschappen van subatomaire soep die het vroege heelal nabootst

- MEMS-in-the-lens-architectuur voor laserscanmicroscopie
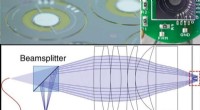
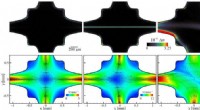
- Eerste directe weergave van een elektronen kort, snelle reis over de grens

- Nieuw inzicht in de stroom van polymeer en levende polymeeroplossingen
- Politiepaarden dragen bij aan natuurkundig onderzoek

 Wat is de kracht die dingen op aarde laat vallen?
Wat is de kracht die dingen op aarde laat vallen?  NASA's Webb Observatory ruimtevaartuig element milieutest update
NASA's Webb Observatory ruimtevaartuig element milieutest update Een golfgeleider met nulindex:onderzoekers observeren voor het eerst rechtstreeks oneindig lange golflengten
Een golfgeleider met nulindex:onderzoekers observeren voor het eerst rechtstreeks oneindig lange golflengten Draculas Chivito:Nieuwe protoplanetaire schijf ontdekt met Pan-STARRS
Draculas Chivito:Nieuwe protoplanetaire schijf ontdekt met Pan-STARRS  Wat gebeurde wanneer u natriummetaal en chloorgas combineert?
Wat gebeurde wanneer u natriummetaal en chloorgas combineert?  Nieuwe inspanningen zijn bedoeld om de forensische wetenschap te versterken, maar zullen ze werken?
Nieuwe inspanningen zijn bedoeld om de forensische wetenschap te versterken, maar zullen ze werken?  Welk deel van de sfeer weerspiegelt radiogolven en veroorzaakt mooi lichtshows zoals Aurora Borealis?
Welk deel van de sfeer weerspiegelt radiogolven en veroorzaakt mooi lichtshows zoals Aurora Borealis?  Milieugroenheid kan de testscores van studenten niet verbeteren, studie vondsten
Milieugroenheid kan de testscores van studenten niet verbeteren, studie vondsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

