
Wetenschap
Hoe verklaart het model van atomen de afbuiging alfa -deeltjes door goudfolies?
Hier is hoe het werkt:
1. Plum Pudding Model: Vóór Rutherford was het heersende model het "pruimpuddingmodel" voorgesteld door J.J. Thomson. Dit model suggereerde dat het atoom een positief geladen bol was met negatief geladen elektronen ingebed, zoals pruimen in een pudding.
2. Rutherford's experiment: Rutherford en zijn team voerden het beroemde Gold Foil -experiment uit. Ze schoten een straal positief geladen alfa -deeltjes op een dun vel goudfolie.
3. Onverwachte resultaten: Volgens het pruimpuddingmodel hadden de alfa -deeltjes de gouden folie moeten doorstaan met minimale afbuiging, omdat de positieve lading werd verondersteld gelijkmatig te worden verdeeld. De resultaten waren echter verbazingwekkend:
* De meeste alfa -deeltjes passeerden rechtdoor: Dit ondersteunde het idee dat atomen meestal lege ruimte zijn.
* Sommige alfa -deeltjes werden onder grote hoeken afgebogen: Dit gaf aan dat ze een sterke positieve kracht binnen het atoom tegenkwamen.
* Een klein aantal alfa -deeltjes werd teruggebogen naar de bron: Dit was het meest verrassende resultaat, wat een sterk geconcentreerde positieve lading binnen het atoom aangeeft.
4. Rutherford's interpretatie: Op basis van deze resultaten stelde Rutherford het nucleaire model van het atoom voor:
* Een kleine, dichte, positief geladen kern: Deze kern bevat bijna alle massa van het atoom en is verantwoordelijk voor het afbuigen van de alfa -deeltjes.
* Elektronen die rond de kern zijn: Elektronen, die veel lichter en negatief geladen zijn, draait de kern in een wolkachtige structuur.
5. Verklaring van afbuiging:
* Wanneer een alfa -deeltje een goudatoom nadert, komt het de positief geladen kern tegen.
* Als het alfa -deeltje in de buurt van de kern passeert, zorgt de elektrostatische afstoting tussen de twee positieve ladingen ervoor dat het alfa -deeltje wordt afgebogen.
* Hoe dichter het alfa -deeltje bij de kern komt, hoe sterker de afstoting en hoe groter de afbuiging.
* In zeldzame gevallen kan een alfa -deeltje rechtstreeks botsen met de kern, wat resulteert in een grote afbuiging, zelfs terug stuiteren.
Samenvattend: Het nucleaire model van Rutherford, gebaseerd op zijn experiment met goudfolie, verklaarde met succes de onverwachte afbuiging van alfa -deeltjes door het bestaan van een kleine, dichte, positief geladen kern binnen het atoom aan te tonen.
 Kenmerken van lipidemoleculen definiëren
Kenmerken van lipidemoleculen definiëren  Het is dringend nodig om na te gaan hoe mannen en vrouwen verschillend reageren op de verzuring van de oceaan
Het is dringend nodig om na te gaan hoe mannen en vrouwen verschillend reageren op de verzuring van de oceaan  Wetenschappers vinden zelfherstellende katalysator voor mogelijk grootschalig gebruik bij waterstofproductie
Wetenschappers vinden zelfherstellende katalysator voor mogelijk grootschalig gebruik bij waterstofproductie Rekbare zonnecellen een stap dichterbij
Rekbare zonnecellen een stap dichterbij Betere adsorptie van chemomedicijnen op gerichte toedieningscapsules
Betere adsorptie van chemomedicijnen op gerichte toedieningscapsules
 Het catastrofale weer in Brazilië leidt tot een golf van complottheorieën
Het catastrofale weer in Brazilië leidt tot een golf van complottheorieën  Viseieren stikken in de riffen van Lake Michigan. Wat is er nodig om deze kwekerijen te redden?
Viseieren stikken in de riffen van Lake Michigan. Wat is er nodig om deze kwekerijen te redden? Traceer arseen in verband met achteruitgang van motorische vaardigheden bij Amerikaans-Indiaanse ouderen
Traceer arseen in verband met achteruitgang van motorische vaardigheden bij Amerikaans-Indiaanse ouderen Voorstanders waaieren uit in een mondiale steunbetuiging voor de wetenschap
Voorstanders waaieren uit in een mondiale steunbetuiging voor de wetenschap  algen, onzuiverheden verdonkeren de Groenlandse ijskap en verhogen het smelten
algen, onzuiverheden verdonkeren de Groenlandse ijskap en verhogen het smelten
Hoofdlijnen
- Gekruiste (evolutionaire) signalen?
- Hoe een cel te splitsen in Two
- Wat noemde wetenschapper de moderne kijk op celmembraanstructuur wat?
- Wat maakt het een uitdaging om gentic materiaal in eukaryotische cellen te verpakken?
- Hoe de kern vormt een pollenkorrel die een vrouwelijke eiercel bemoeilijkt?
- Wat is de dimensie buiten het waargenomen bereik voor menselijke cellen?
- Een muis of een olifant:welke soort bestrijdt infecties effectiever?
- Uit onderzoek blijkt hoe het ene enzym op het andere meelift om tRNA te herkennen
- Is een complexe structurele organisatie niet kenmerkend voor levende organismen?
- Initialisatie van kwantumsimulatoren door sympathieke koeling
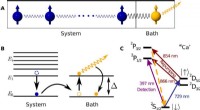
- Wat als donkere materie lichter is? Rapport roept op tot kleine experimenten om de jacht te verbreden

- Natuurkundigen bepalen voor het eerst de nauwelijks meetbare eigenschapentropie in complexe plasma's

- Surfen op golven in een eendimensionale kwantumvloeistof
- Quantumonderzoekers creëren een foutcorrigerende kat

 Waterkwaliteit bestuderen met satellieten en openbare data
Waterkwaliteit bestuderen met satellieten en openbare data Droefheid, walging, woede:angst voor het Great Barrier Reef maakte klimaatverandering urgent
Droefheid, walging, woede:angst voor het Great Barrier Reef maakte klimaatverandering urgent Wat zijn de grote ideeën van wetenschap?
Wat zijn de grote ideeën van wetenschap?  MRI-technologie terugbrengen tot micrometerschalen
MRI-technologie terugbrengen tot micrometerschalen 2 dingen die Rutherford over het atoom heeft ontdekt?
2 dingen die Rutherford over het atoom heeft ontdekt?  Welk proces verwering of erosie is gemakkelijker te zien daadwerkelijk plaatsvinden?
Welk proces verwering of erosie is gemakkelijker te zien daadwerkelijk plaatsvinden?  Verandert het oplossen van een suikerkubus in kopje chemische kopje chemische kop?
Verandert het oplossen van een suikerkubus in kopje chemische kopje chemische kop?  Nieuwe studie zegt dat moderne krokodillen en alligators uit verschillende omgevingen kwamen
Nieuwe studie zegt dat moderne krokodillen en alligators uit verschillende omgevingen kwamen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

