
Wetenschap
Rigide container bevat waterstofgas bij een druk van 3,0 atmosferen en temperatuur 2 graden Celsius wat zal Bethe als het wordt verhoogd tot 10 Celsius?
Inzicht in de concepten
* Ideale gaswet: De ideale gaswet beschrijft de relatie tussen druk (p), volume (v), temperatuur (t) en het aantal mol (n) van een ideaal gas:pv =nrt.
* constant volume: Omdat de container star is, blijft het volume (v) constant.
* Directe evenredigheid: De ideale gaswet toont aan dat druk (P) recht evenredig is met temperatuur (T) wanneer volume (V) en mol (N) constant zijn.
Berekeningen
1. Converteer temperaturen naar Kelvin:
* 2 ° C + 273.15 =275.15 K
* 10 ° C + 273.15 =283.15 K
2. Stel een verhouding in:
Omdat volume en mol constant zijn, kunnen we schrijven:
P₁/t₁ =p₂/t₂
Waar:
* P₁ =Initiële druk (3,0 atm)
* T₁ =begintemperatuur (275,15 K)
* P₂ =uiteindelijke druk (onbekend)
* T₂ =Eindtemperatuur (283,15 K)
3. Oplossen voor P₂:
* P₂ =(p₁ * t₂) / t₁
* P₂ =(3,0 atm * 283.15 k) / 275.15 k
* P₂ ≈ 3.09 ATM
Antwoord
De druk in de container zal toenemen tot ongeveer 3,09 atmosferen Wanneer de temperatuur wordt verhoogd tot 10 graden Celsius.
 Wat zijn grote moleculen gemaakt van kleine genaamd?
Wat zijn grote moleculen gemaakt van kleine genaamd?  Onderzoekers onthullen reactieve galliumhydridesoorten op galliumoxideoppervlak
Onderzoekers onthullen reactieve galliumhydridesoorten op galliumoxideoppervlak Onderzoekers richten zich op formulering, productie-uitdagingen bij obesitas en diabetesmedicijnen
Onderzoekers richten zich op formulering, productie-uitdagingen bij obesitas en diabetesmedicijnen  Hoe verschilt de samenstelling van een mengsel van waterstof en zuurstof van een verbinding die zuurstof bevat?
Hoe verschilt de samenstelling van een mengsel van waterstof en zuurstof van een verbinding die zuurstof bevat?  De effecten van zuur op verschillende soorten metaal
De effecten van zuur op verschillende soorten metaal
 Reproductie van planten en dieren
Reproductie van planten en dieren Wat is de samenvatting van planten die beter worden onder zonlicht of kunstlicht?
Wat is de samenvatting van planten die beter worden onder zonlicht of kunstlicht?  Mississippi River zakt genoeg om te beginnen met het sluiten van grote overlaat
Mississippi River zakt genoeg om te beginnen met het sluiten van grote overlaat Een nieuwe inleiding over klimaatverandering
Een nieuwe inleiding over klimaatverandering Net zero:klimaatbesparende doelstelling of vertragingstactiek?
Net zero:klimaatbesparende doelstelling of vertragingstactiek?
Hoofdlijnen
- Een 3D-model plantencel maken zonder voedsel
- Nieuw onderzoek laat zien hoe sommige kippen gestreepte veren kregen
- De diepe slaap van een ziekenhuispathogeen:waarom infecties met Acinetobacter baumannii weer kunnen oplaaien en
- Hoe zorgt de structurele organisatie van membranen voor transport en erkenning?
- Wat zijn de soorten gespecialiseerde cellen in planten?
- Wat is de vrouwelijke gameet?
- Law of Segregation (Mendel): definitie, toelichting en voorbeelden
- Kan inzicht in het gedrag van eigenaren de gezondheid en het welzijn van paarden verbeteren?
- Waarom zou de praktijk van gordelling ervoor zorgen dat boom sterft?
- Ontwikkelen van de bouwstenen van de toekomst voor fotovoltaïsche energie

- Kristallen produceren zonder gebreken voor onderzoek

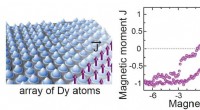
- Superrooster van magneten met één atoom streeft naar de ultieme limiet van gegevensopslag met hoge dichtheid
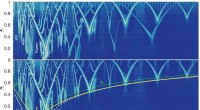
- Toegang tot de bogen van chaos in het zonnestelsel voor snel transport
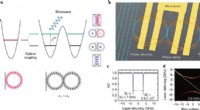
- Elektronisch programmeerbaar fotonisch molecuul
 Eerste geïntegreerde laser op lithiumniobaatchip
Eerste geïntegreerde laser op lithiumniobaatchip Ferro-elektrische polymeren veelzijdiger gemaakt
Ferro-elektrische polymeren veelzijdiger gemaakt Edward C. Baig:Review:Een paar hobbels, maar Waze en Apple CarPlay sturen je in de goede richting
Edward C. Baig:Review:Een paar hobbels, maar Waze en Apple CarPlay sturen je in de goede richting Twee niet -metalen atomen reageren en een verbinding wordt gevormd die heeft wat voor soort binding?
Twee niet -metalen atomen reageren en een verbinding wordt gevormd die heeft wat voor soort binding?  De wolken barsten voor betere communicatie
De wolken barsten voor betere communicatie Wat drijft mensen op het gebied van milieu?
Wat drijft mensen op het gebied van milieu?  Jaar in de ruimte zet Amerikaanse astronautenziekteverdediging op scherp
Jaar in de ruimte zet Amerikaanse astronautenziekteverdediging op scherp Als merken ons verleiden om te liegen, vals spelen en stelen
Als merken ons verleiden om te liegen, vals spelen en stelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

