
Wetenschap
Wat is het maximale aantal elektronen dat in een orbitaal is toegestaan?
Dit is gebaseerd op het Pauli -uitsluitingsprincipe, dat stelt dat geen twee elektronen in een atoom dezelfde set van vier kwantumnummers kunnen hebben.
* n (Hoofdkwantumnummer) beschrijft de elektronenschil.
* l (Angular Momentum Quantum Number) beschrijft de subshell (vorm van het orbitaal).
* ml (magnetisch kwantumnummer) beschrijft de oriëntatie van het orbitaal in de ruimte.
* MS (Spin Quantum Number) beschrijft het intrinsieke hoekmomentum van het elektron, dat kan worden gesplitst (+1/2) of spin naar beneden (-1/2).
Omdat het spin -kwantumnummer slechts twee waarden kan hebben, kan een orbitaal slechts maximaal twee elektronen bevatten, één met spin -up en één met spin naar beneden.
 Wat zijn de stappen van de stikstofcyclus?
Wat zijn de stappen van de stikstofcyclus?  Welke fysische en chemische veranderingen treden op wanneer een waskaars verbrandt?
Welke fysische en chemische veranderingen treden op wanneer een waskaars verbrandt?  Hoe de griep werkt
Hoe de griep werkt  Ingenieurs introduceren een nieuwe aanpak voor het recyclen van kunststoffen
Ingenieurs introduceren een nieuwe aanpak voor het recyclen van kunststoffen Duurzaam, hoogwaardig papiercoatingmateriaal zou de vervuiling door microplastic kunnen verminderen
Duurzaam, hoogwaardig papiercoatingmateriaal zou de vervuiling door microplastic kunnen verminderen
 Orkanen zijn groter en destructiever geworden voor de VS, studie vondsten
Orkanen zijn groter en destructiever geworden voor de VS, studie vondsten Slim en sociaal? Uitgebreide analysevragen stellen verband tussen socialiteit en hersentoename bij carnivoren
Slim en sociaal? Uitgebreide analysevragen stellen verband tussen socialiteit en hersentoename bij carnivoren  Kunnen moderne planten hun Nieuw-Zeelandse afkomst traceren?
Kunnen moderne planten hun Nieuw-Zeelandse afkomst traceren?  Overwinningen op het gebied van natuurbehoud in het Amazone-regenwoud zorgen voor verliezen aan buren
Overwinningen op het gebied van natuurbehoud in het Amazone-regenwoud zorgen voor verliezen aan buren De natuur is de sleutel tot het koesteren van groene waterzuiveringsinstallaties
De natuur is de sleutel tot het koesteren van groene waterzuiveringsinstallaties
Hoofdlijnen
- Wat zijn de secties van DNA die codeert voor een eiwit en de kern verlaten?
- De rol van enzymen bij cellulaire ademhaling
- Wetenschappers ontsluiten het geheim van wat planten doet bloeien
- Wat is de wetenschappelijke naam van elektrische familie?
- Welke soorten dieren eten balpythons?
- Is een hoorn des overvloeds homogeen of heterogeen?
- Wat is speciaal aan sekschromosomen?
- De internationale Human Cell Atlas publiceert strategische blauwdruk, kondigt gegevens aan van de eerste miljoen cellen
- Orka's vallen opnieuw schepen aan:hier is een geschiedenis van de praktijk
- Een nieuw raamwerk om spatiotemporele signaalvoortplanting in complexe netwerken te voorspellen

- Nieuwe inzichten versterken Einsteins idee over hoe warmte door vaste stoffen beweegt
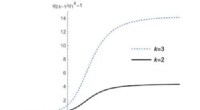
- Zwarte gaten gedragen zich soms als conventionele kwantumsystemen
- De combinatie van klassieke en kwantumcomputers opent de deur naar nieuwe ontdekkingen

- Zo ziet een openhartoperatie bij de LHC eruit

 Over het hele spectrum:onderzoekers vinden een manier om de kleur van licht in materiaal van de volgende generatie te stabiliseren
Over het hele spectrum:onderzoekers vinden een manier om de kleur van licht in materiaal van de volgende generatie te stabiliseren Wat is een spiritueel doel?
Wat is een spiritueel doel?  Poreuze materialen en machine learning bieden een goedkope monitoringmethode voor microplastics
Poreuze materialen en machine learning bieden een goedkope monitoringmethode voor microplastics  Welke krachten veroorzaken verwering en erosie?
Welke krachten veroorzaken verwering en erosie?  Zijn er subsystemen binnen het spijsverteringssysteem?
Zijn er subsystemen binnen het spijsverteringssysteem?  AI-ondersteund schrijven is stilletjes in opkomst in academische tijdschriften – hier is waarom dat oké is
AI-ondersteund schrijven is stilletjes in opkomst in academische tijdschriften – hier is waarom dat oké is  Vraag en antwoord:Seizoenseconomie van voedsel tijdens een pandemie
Vraag en antwoord:Seizoenseconomie van voedsel tijdens een pandemie Wat is de kinetische energiecoëfficiënt?
Wat is de kinetische energiecoëfficiënt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

