
Wetenschap
Waarom botst het elektron in waterstof niet met het proton?
De golffuncties van elektronen en protonen in een waterstofatoom zijn zodanig dat de kans dat een elektron op dezelfde locatie als een proton wordt aangetroffen zeer klein is. Dit komt omdat de golffuncties van elektronen en protonen verschillende vormen hebben, en ze ook gescheiden zijn door een gebied in de ruimte dat bekend staat als de 'Bohr-straal'. De Bohr-straal is de gemiddelde afstand tussen het elektron en het proton in een waterstofatoom.
De wetten van de kwantummechanica voorkomen ook dat het elektron in een spiraal in het proton terechtkomt. Dit komt omdat het elektron een bepaalde hoeveelheid impulsmoment heeft, wat een maat is voor zijn rotatie. Het impulsmoment van het elektron houdt het in een baan rond het proton.
In de klassieke natuurkunde zou een elektron in een proton terechtkomen omdat het voortdurend energie zou verliezen door elektromagnetische straling. In de kwantummechanica kan het elektron echter alleen energie verliezen in discrete hoeveelheden, ook wel quanta genoemd. De hoeveelheid energie die het elektron kan verliezen wordt bepaald door het verschil tussen de energieniveaus van de banen van het elektron. De energieniveaus van de banen van het elektron zijn gekwantiseerd, wat betekent dat ze alleen bepaalde waarden kunnen hebben.
Het laagste energieniveau van het elektron in een waterstofatoom staat bekend als de 'grondtoestand'. Het elektron kan geen energie verliezen en in het proton terechtkomen, tenzij het voldoende energie heeft om het volgende energieniveau te bereiken, dat bekend staat als de 'aangeslagen toestand'. De energie die nodig is om het elektron naar het volgende energieniveau te exciteren is groter dan de energie die het elektron kan verliezen door elektromagnetische straling. Dit is de reden waarom het elektron niet in het proton spiraalt.
 Ingenieurs evalueren de factoren die de batterijprestaties bij lage temperaturen beïnvloeden
Ingenieurs evalueren de factoren die de batterijprestaties bij lage temperaturen beïnvloeden Hoe de eerste ionisatie-energie van het waterstofatoom te berekenen met betrekking tot de Balmer-serie
Hoe de eerste ionisatie-energie van het waterstofatoom te berekenen met betrekking tot de Balmer-serie Hoe versnel je de vorming van kristallen tijdens kristallisatie?
Hoe versnel je de vorming van kristallen tijdens kristallisatie?  Wat is een vaste, zuivere zure verbinding?
Wat is een vaste, zuivere zure verbinding?  Concentrische cirkelvormige polarisatiebanden gevonden in een ferro-elektrisch polymeer
Concentrische cirkelvormige polarisatiebanden gevonden in een ferro-elektrisch polymeer
 Hoe klimaatverandering ecosystemen ontwricht
Hoe klimaatverandering ecosystemen ontwricht  Onderzoek suggereert dat wetenschappers microbiële metingen kunnen gebruiken om rivierstroming te meten
Onderzoek suggereert dat wetenschappers microbiële metingen kunnen gebruiken om rivierstroming te meten Het prehistorische verleden verbinden met de wereldwijde toekomst
Het prehistorische verleden verbinden met de wereldwijde toekomst Hoe het weer kan worden beschreven voor Preschoolers
Hoe het weer kan worden beschreven voor Preschoolers Ambtenaren:Meer dan 40 procent van Californië uit droogte
Ambtenaren:Meer dan 40 procent van Californië uit droogte
Hoofdlijnen
- Termieten spelen mogelijk een grotere rol in toekomstige ecosystemen
- Waarom hebben mensen niet dezelfde genetische informatie als iemand anders?
- Wilde druivengist kan effectiever zijn dan pesticiden bij het voorkomen van druivenschimmels
- Keizerspinguïns kunnen record snel inkorten door te snacken
- Hartmonitors op wilde narwallen onthullen alarmerende reacties op stress
- Kunnen leeuwen samenleven met vee in Afrika?
- Onderzoek onthult verschillen in DNA-vouwing tussen neuronen en andere hersencellen en koppelt deze aan celfuncties
- Cultuur assimileren – wat taal ons vertelt over immigratie en integratie
- Kunnen we leren om van slakken en slakken te houden in onze tuinen?
- Vleermuizen inspireren detectoren om lekkage van olie- en gasleidingen te voorkomen

- Nieuwe benadering voor röntgenmetingen kan CT-scanners verbeteren
- Een nieuwe test om de oorsprong van de kosmische structuur te onderzoeken
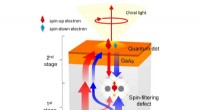
- Onderzoekers melden doorbraak die praktische halfgeleiderspintronica mogelijk maakt
- Nieuw lasergebaseerd microfoonkalibratiesysteem

 Eilandbewoners in de Stille Oceaan halen al lang wijsheid uit de aarde, de lucht en de golven – de wetenschap ondersteunt ze
Eilandbewoners in de Stille Oceaan halen al lang wijsheid uit de aarde, de lucht en de golven – de wetenschap ondersteunt ze  NASA analyseert regenval in nieuwe tropische storm Tapah
NASA analyseert regenval in nieuwe tropische storm Tapah Hoeveel mol waterstofgas wordt er geproduceerd uit 250,0 milliliter 3,0 M HCl in een overmaat Mg?
Hoeveel mol waterstofgas wordt er geproduceerd uit 250,0 milliliter 3,0 M HCl in een overmaat Mg?  Kan materiaal dat rivaliseert met grafeen uit rotsen worden gewonnen? Ja, als...
Kan materiaal dat rivaliseert met grafeen uit rotsen worden gewonnen? Ja, als...  Hoe voorspellingsmarkten het klimaatrisicobeleid en investeringsbeslissingen kunnen verbeteren
Hoe voorspellingsmarkten het klimaatrisicobeleid en investeringsbeslissingen kunnen verbeteren Ons vermogen om letters te herkennen kan in onze hersenen verankerd zijn
Ons vermogen om letters te herkennen kan in onze hersenen verankerd zijn Hoe bewaart u zuren en basen
Hoe bewaart u zuren en basen  Waarom verschillen geometrische isomeren in hun fysische en chemische eigenschappen?
Waarom verschillen geometrische isomeren in hun fysische en chemische eigenschappen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

