
Wetenschap
Natuurkunde ontmoet biologie:hoe bacteriën synchroniseren om complexe structuren te bouwen
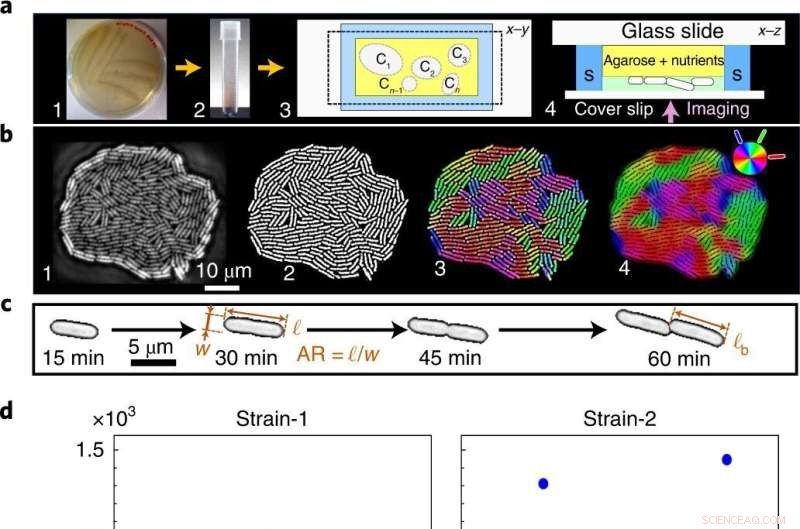
Van luidruchtige fenotypes tot een statistisch nauwkeurige overgang van één naar meer lagen. een , Cellen die zijn uitgestreken op een voedingsrijke agarplaat (1) worden overgebracht in het vloeibare medium (2) en vervolgens gezaaid in de microfluïdische kamer, hier Ci geeft individuele kolonies (3) aan, voor time-lapse-beeldvorming met fasecontrast (4) in het zwembad (S). b , Onbewerkte afbeeldingen van groeiende kolonies (1) worden gebinariseerd om fenotypische eigenschappen te extraheren (2) en kleurgecodeerd om de lokale celoriëntatie te visualiseren (3,4). c , Eencellige geometrische eigenschappen:AR en ℓ b . d ,e , A c is onafhankelijk van de groeitemperatuur (d ), zoals blijkt uit onze theorie en experimenten, terwijl t c is temperatuurafhankelijk (e ). Blauwe en rode punten geven verschillende biologische replica's aan (inclusief meerdere technische replica's) voor A c en t c experimentele gegevens. A c heeft een grote variatie in alle T , terwijl t c heeft een lage variantie, die verder minimaliseert met de groeitemperatuur. v , Kenmerkende fenotypische ruis, gekwantificeerd als de genormaliseerde variantie, F = var(⋯)/〈⋯〉 2 , over T :ℓ b (blauwe vierkantjes), A c (rode driehoekjes), cellengte verdubbelingstijd τ sc (zwarte ruiten), AR (magenta driehoeken) en t c (groene cirkels). Ondanks de hoge fenotypische ruis op individuele schalen (ℓ b , AR en τ sc ), t c is statistisch nauwkeurig (overeenkomende ruis is orden van grootte lager over alle T ). De foutbalk geeft de standaarddeviatie van F over kolonies aan. Krediet:Natuurfysica (2022). DOI:10.1038/s41567-022-01641-9
Bacteriën werken samen en coördineren collectief terwijl ze een gedeelde structuur vormen die een biofilm wordt genoemd, zoals de tandplak op onze tanden of het microbioom dat met onze darmen wordt geassocieerd. Deze zelforganisatie in meerdere complexe lagen - ondanks variaties van cellulaire eigenschappen op individueel niveau - vereist dat de levende systemen een gemeenschappelijke, maar precieze tijd delen, die nu is ontdekt door natuurkundigen van de Universiteit van Luxemburg.
Prof. Anupam Sengupta en zijn team legden dit uit door in te zoomen op de groei en ontwikkeling van ontluikende bacteriële biofilms, waarbij ze opkomende kruisgesprekken tussen biofysische eigenschappen ontdekken die een nauwkeurige timing van structurele, topologische en hydrodynamische overgangen op populatieschalen mogelijk maken. De baanbrekende bevindingen verschijnen in de recente editie van het tijdschrift Nature Physics .
Bacteriële biofilms zijn te vinden op bijna elk natuurlijk en kunstmatig oppervlak dat we tegenkomen. Ze zijn cruciaal voor het menselijk bestaan:van die in de darmen die ons fysieke welzijn reguleren, tot degenen die de progressie van kanker reguleren en ons ecosysteem in balans houden. Dankzij de voortreffelijke fysisch-chemische feedbackmechanismen die hun vruchtbare, aan het oppervlak gerelateerde levensstijlen bemiddelen, zijn biofilms zeer veerkrachtig en kunnen ze verschillende systemen koloniseren.
Recent eencellig onderzoek door Prof. Sengupta en medewerkers hebben de cruciale rol onthuld die eencellige geometrie en groeidynamiek spelen bij het vormgeven van de dynamische eigenschappen van groeiende bacteriële lagen. Maar hoe variabiliteit in statistieken op celniveau - een volledig onbekende speler in bestaande modellen van levende en actieve materie - van invloed is op opkomende collectieve verschijnselen in bacteriële biofilms, is een uitdaging gebleven en dus grotendeels onontgonnen.
Nu lossen onderzoekers van de Physics of Living Matter Group van de Universiteit van Luxemburg dit al lang bestaande raadsel op:hoe biofilms - en levende systemen in het algemeen - de timing reguleren van belangrijke ontwikkelingsgebeurtenissen die voortkomen uit individuen met zeer variabele en dynamische eigenschappen. Met een kwantitatieve interdisciplinaire benadering om te spioneren binnen ontluikende bacteriële biofilms, biedt het team van prof. Sengupta de mechanistische onderbouwing van hoe goed getimede ontwikkelingsstappen gezamenlijk ontstaan dankzij de zelfregulatie van eigenschappen op celniveau, die onderling overleg plegen om elk te verminderen. de ruiseffecten van anderen, wat uiteindelijk een nauwkeurige timing van belangrijke ontwikkelingsgebeurtenissen mogelijk maakt.
Het werk gaat dieper in op het rationaliseren van de resultaten, waardoor een fysiologisch consistent beeld ontstaat op basis van de metabolische vereisten tijdens de vroege stadia van biofilmontwikkeling. De resultaten laten zien hoe zelfregulering van fenotypische ruis goed getimede overgangen in de structuur, topologie en actieve stromen in bacteriekolonies aandrijft, en benadrukt de strategische rol van fysica bij het begrijpen van biologische systemen. Het werk past in grote lijnen in het Physics Meets Biology-initiatief binnen de Universiteit van Luxemburg.
Lawaaierige fenotypes zorgen voor goed getimede ontwikkelingsgebeurtenissen
Ondanks de variabiliteit in fenotypische eigenschappen, zoals celgeometrie, groeisnelheden en oppervlakteassociatie, ondergaan bacteriële biofilms kritische ontwikkelingsstappen in hun levenscyclus op precieze tijdstippen, te beginnen met de mono-naar-meerlaagse overgang (MTMT). Na deze belangrijke structurele overgang wordt een opkomende cascade op gang gebracht, die synchroon de veranderingen in topologie en actieve stroomvelden binnen en in de buurt van de ontluikende biofilms timet.
De belangrijkste fenotypische kenmerken van de catalogus in Escherichia coli en Serratia marcescens groeien onder verschillende omstandigheden (nutriëntenniveaus en temperaturen), waardoor een zorgvuldige controle van de biologische activiteit mogelijk is, en kwantificeren hoe de overspraak tussen fenotypische geluiden de tijdigheid van structurele organisatie en opkomst van actief plaatselijk vervoer. Dit werk smeedt dus de eerste directe, mechanistische link tussen activiteitsafhankelijke variabiliteit op celniveau en opkomende eigenschappen op populatieschaal in levende systemen.
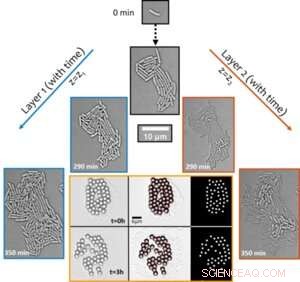
Figuur 1. Structurele overgang van ontluikende biofilms van mono- naar multi-layers zorgt voor opkomend synchroon transport rond de kolonie. Het actieve transportfenomeen werd blootgelegd door de verplaatsing van deeltjes ter grootte van een micron in de tijd te visualiseren (getoond in de afbeelding met zes panelen met oranje rand). Credit:Universiteit van Luxemburg
Gebruikmaken van een schaaloverschrijdende en interdisciplinaire benadering
Met behulp van een combinatie van eencellige time-lapse-beeldvorming, deeltjesbeeldsnelheidsmeting, numerieke simulaties en continuümmodellering, kwantificeert het team de variabiliteit op celniveau in termen van fenotypische ruis, en legt het afwegingen bloot die uiteindelijk de variabiliteit in opkomende eigenschappen onderdrukken en weergeven synchroon. In het bijzonder, een afweging tussen de ruis in de celgeometrie en de groeisnelheid zelfreguleert de timing van de mono-naar-meerlaagse-overgang (MTMT), een belangrijke stap in de initiatie van biofilm, waarbij een synchrone actieve hydrodynamische cascade wordt veroorzaakt die zorgt uiteindelijk voor verbeterd lokaal transport rond de samenvloeiende bacteriekolonies.
Opmerkelijk is dat, ondanks dat de soort niet-beweeglijk van aard is, de groei-afhankelijke actieve hydrodynamica binnen samenvloeiende kolonies lokale stromingen in hun omgeving veroorzaakt die sterk genoeg zijn om zelf-geassembleerde deeltjesclusters (gebruikt als tracers, zie figuur 1) te verstoren en te transporteren actief in de microbiële omgeving. De verbetering van het transport - in een anderszins diffusie-beperkte omgeving - met meer dan twee ordes van grootte suggereert biologische functies van dergelijke actieve stromen in het transport van moleculaire en micro-vracht tijdens de vroege stadia van biofilmontwikkeling.
Dit werk biedt een doorbraak in het domein van de fysica van microbiële actieve materie en biedt een nieuw paradigma om te begrijpen hoe samenvloeiende bacteriële populaties kunnen omgaan met omgevingsvariaties, inclusief die welke worden opgelegd door levensstijl en klimaatveranderingen, door gebruik te maken van hun variabiliteit op individuele schaal.
Perspectieven op het synchrone actieve transport in ontluikende biofilms
Het team toont aan dat sessiele kolonies actieve stromen kunnen genereren en benutten voor het pendelen van biologische lading van submicron tot micron die algemeen wordt geassocieerd met bacteriekolonies. Alles bij elkaar genomen hebben de bijbehorende overspanningen van de microlading een omvang van tientallen nanometers tot enkele microns. Typische microlading omvat bacteriële cellen (verschillende drager- en ladingsoorten van microngrootte), schimmelsporen op micronschaal; liposomen en extracellulaire blaasjes die genetische of biochemische lading leveren (tientallen tot honderden nanometers groot), liftende bacteriofagen (honderden nanometers) en synthetische kralen en capsules die relevant zijn voor medicijnafgifte (submicrons tot tientallen microns groot).
De biologische betekenis van de tijdsynchrone nexus tussen structuur-stroom-transport is meerledig:strikte timing van de extrusiegebeurtenissen presenteert MTMT als een biofysische proxy voor quorum-achtige detectie tussen de kolonies, met mogelijke vertakkingen van en in synchrone selectie voor resistente cellen (bijvoorbeeld tegen antibiotica). Het verstoren van de goed gedefinieerde MTMT-timing (bijvoorbeeld door omgevingsfactoren op de juiste manier af te stemmen) zou toekomstige alternatieven kunnen bieden om quorum-sensing te remmen en daardoor de bacteriële resistentie tegen antibiotica te reguleren.
Vooruitkijkend, zal het van cruciaal belang zijn om te begrijpen hoe sessiele kolonies de goed gedefinieerde kritieke tijd benutten om communicatie tussen kolonies af te stemmen onder stressvolle omgevingen (in de parameterruimte van intrinsieke ruis en tijdsynchroniciteit van structuurstroom). De door ruis gemedieerde ruimte-tijdfenomenen die in dit werk worden gepresenteerd, bieden belangrijke ontbrekende inzichten in de ontwikkelingsbiofysica van morfogenese in systemen met een hogere complexiteit, waaronder polymicrobiële consortia waargenomen in de menselijke en plantaardige microbiomen, en meercellige weefselsystemen die relevant zijn voor embryonale en kanker progressie.
Dit werk opent nieuwe onderzoekspaden op het gebied van fysica van microbiële actieve materie, zachte en biologische fysica en celbiologie, en - vanwege de belangrijke rol van bacteriële biofilms in het menselijk microbioom en milieu-ecologie - ook biomedische en biotechnologische wetenschappen. De structurele en multiveld-topologische resultaten die hier door de visie van prof. Sengupta worden gepresenteerd, zullen gevolgen hebben voor diverse confluente systemen die actieve weefsel- en celsystemen omvatten, en een breed scala aan organoïde modellen.
Ten slotte biedt dit werk een nieuw experimenteel modelsysteem voor onderzoek naar actieve materie waarbij passieve entiteiten naast actieve middelen bestaan, en een nieuwe klasse van theoretische modellen inspireren die cellulaire variabiliteit en compromissen daarin opnemen om de impact van ruis te begrijpen, een intrinsiek biofysische variabele, over opkomende eigenschappen in levende systemen. + Verder verkennen
Onderzoekers manipuleren demografie van de bacteriële gemeenschap met nieuwe elektronische technologie
 Voordelen en nadelen van natuurlijke omgevingen
Voordelen en nadelen van natuurlijke omgevingen  Verbeteringen in de kortetermijnvoorspelling van luchtverontreinigingsniveaus
Verbeteringen in de kortetermijnvoorspelling van luchtverontreinigingsniveaus Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa
Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa Wetenschappers vinden activiteit van voor de aardbeving in centraal Alaska
Wetenschappers vinden activiteit van voor de aardbeving in centraal Alaska Aankomend EU-chef zegt klimaatfonds te lanceren
Aankomend EU-chef zegt klimaatfonds te lanceren
Hoofdlijnen
- Hoe is de taal geëvolueerd?
- Lijst van eencellige organismen
- Dahls paddenkopschildpad bedreigd door versnipperd leefgebied, krimpende bevolking
- Een verticale laminaire luchtstromingskap reinigen
- Afbrekende koraalriffen slecht nieuws voor commerciële visserij
- Een aanpassing 150 miljoen jaar in de maak
- Detectie van nieuwe eiwitten in actieve muizenhersenen
- Wetenschappers pleiten voor verbeterde technologieën om bedreigde Californische zalm te redden
- Chloroplasten zijn de plantencellen die energie produceren
- Elektrische spinfiltering de sleutel tot ultrasnelle, energiezuinige spintronica

- nieuwe materialen, verwarmd onder hoge magnetische velden, recordniveaus van energie kunnen produceren, model toont
- Alfabet van 140 puzzelstukjes programma's origami
- Terahertz-spectroscopie komt in het regime van één molecuul
- Handgeschreven voorbeeld van de beroemde Einstein-vergelijking krijgt $ 1,2 miljoen

 Onderzoekers stellen een nieuwe theorie voor om ijzeroxide-concreties in Utah en Mongolië te verklaren
Onderzoekers stellen een nieuwe theorie voor om ijzeroxide-concreties in Utah en Mongolië te verklaren Analyse van percentages van politiegerelateerde dodelijke slachtoffers vindt significante rasgerelateerde verschillen
Analyse van percentages van politiegerelateerde dodelijke slachtoffers vindt significante rasgerelateerde verschillen De impact van een aardbeving kan worden beïnvloed door seizoensfactoren, historische studie toont
De impact van een aardbeving kan worden beïnvloed door seizoensfactoren, historische studie toont De verborgen structuur van het periodiek systeem
De verborgen structuur van het periodiek systeem Neutronensterren werpen licht op quarkmaterie
Neutronensterren werpen licht op quarkmaterie China benoemt en beschaamt techreuzen voor app-privacyschendingen
China benoemt en beschaamt techreuzen voor app-privacyschendingen Robuuste aanpak voor het minimaliseren van kosten in stroomdistributienetwerken
Robuuste aanpak voor het minimaliseren van kosten in stroomdistributienetwerken Vervanging van schone stroom is erger dan niets, kost meer dan 3, 500 levens en $ 33 miljard per jaar
Vervanging van schone stroom is erger dan niets, kost meer dan 3, 500 levens en $ 33 miljard per jaar
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

