
Wetenschap
Er is een neutronenbundel nodig om een proton te vinden
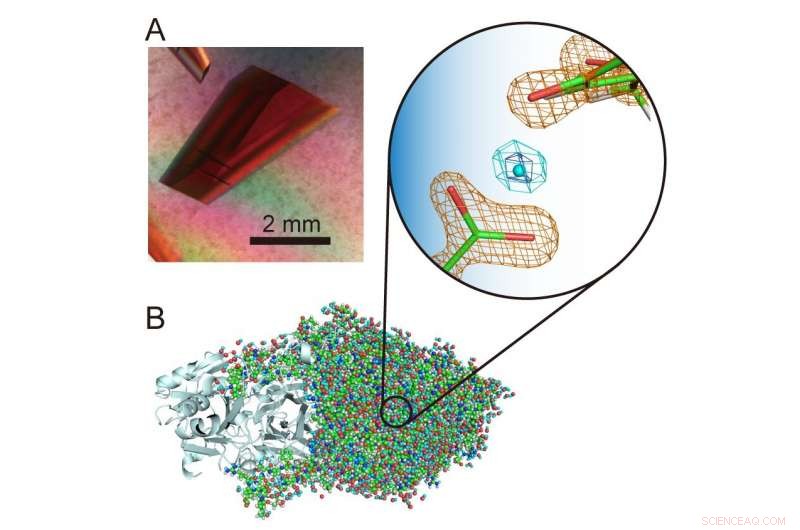
(A) Extra groot kristal van een koperamine-oxidase. (B) Driedimensionale structuur van het koperamine-oxidase inclusief waterstofatomen. Een ongewoon "zwevend" proton wordt gepresenteerd in het midden van de vergrote weergave. Krediet:Universiteit van Osaka
Het begrijpen van het gedrag van eiwitten en enzymen is de sleutel tot het ontrafelen van de geheimen van biologische processen. De atomaire structuren van eiwitten worden over het algemeen onderzocht met behulp van röntgenkristallografie; echter, de precieze informatie voor waterstofatomen en protonen (waterstofionen) is meestal onbereikbaar. Nu een team met inbegrip van de Universiteit van Osaka, Osaka Medisch College, Nationale instituten voor kwantum- en radiologische wetenschap en technologie, Ibaraki-universiteit, en de Universiteit van Tsukuba heeft neutronenkristallografie gebruikt om structurele details met hoge resolutie van een zeer groot oxidase-eiwit te onthullen. Hun bevindingen zijn gepubliceerd in PNAS .
De waterstofatomen en protonen die ongeveer de helft van de atomen in eiwitten en enzymen uitmaken, spelen vaak een cruciale rol in het werk dat deze biomoleculen doen; echter, hun exacte posities zijn moeilijk vast te stellen vanwege hun kleine formaat. De meest gebruikelijke benadering voor het uitwerken van de structuur van een eiwit is om een bundel hoogenergetische röntgenstralen op een eiwitkristal te richten en het diffractiepatroon te analyseren dat het resultaat is van de interacties van de röntgenstralen met de elektronen van atomen in de structuur. Helaas, Röntgenstralen hebben geen sterke wisselwerking met waterstofatomen of protonen, die een lage of geen elektronendichtheid hebben, waardoor ze moeilijk te 'zien' zijn.
Een oplossing is om een neutronenbundel op het kristal aan te brengen in plaats van röntgenstraling. Neutronen interageren met de kernen van de atomen op hun pad, inclusief die van waterstofatomen en protonen, ondanks dat ze klein zijn. De diffractiepatronen die het gevolg zijn van deze interacties worden geregistreerd nadat de neutronenbundel door het kristal is gegaan, en worden gedecodeerd tot de precieze locaties van de kernen, inclusief de waterstofkernen.
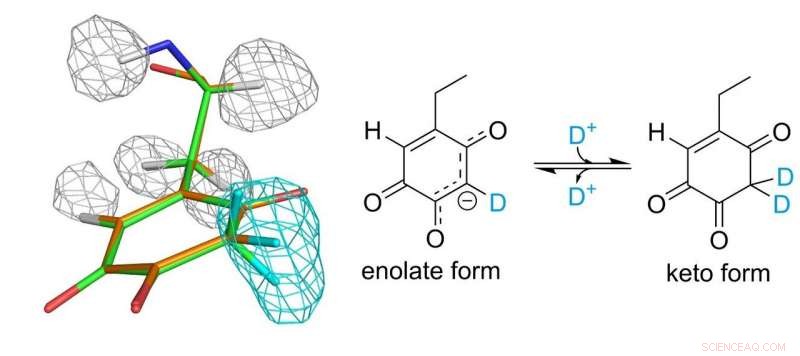
Structuur van tochinon-cofactor. Grijze en lichtblauwe mazen vertegenwoordigen dichtheden van waterstof- en deuteriumatomen, respectievelijk. Krediet:Universiteit van Osaka
"Waterstofatomen en protonen zijn bijzonder interessante componenten van enzymstructuren omdat ze kwantumgedrag kunnen vertonen waarvan recent is vastgesteld dat het cruciaal is voor de enzymfunctie. Het is daarom belangrijk om hun locaties in de eiwitstructuur nauwkeurig te bepalen om te ontrafelen wat er gebeurt , " studie corresponderende auteur Toshihide Okajima legt uit. "Met behulp van neutronenkristallografie, konden we de structuur bepalen van een bacterieel koperamine-oxidase met een molecuulgewicht van 70, 600 - wat extreem groot is voor neutronenkristallografie en aanzienlijk groter is dan eerder geregistreerde molecuulmassa's - en nog steeds nauwkeurig de waterstofatomen en protonen in de structuur lokaliseren. Een ongewoon 'zwevend' proton werd waargenomen tussen een cofactor, topa-chinon, en een aminozuurresidu dat strikt geconserveerd is in deze klasse van enzymen."
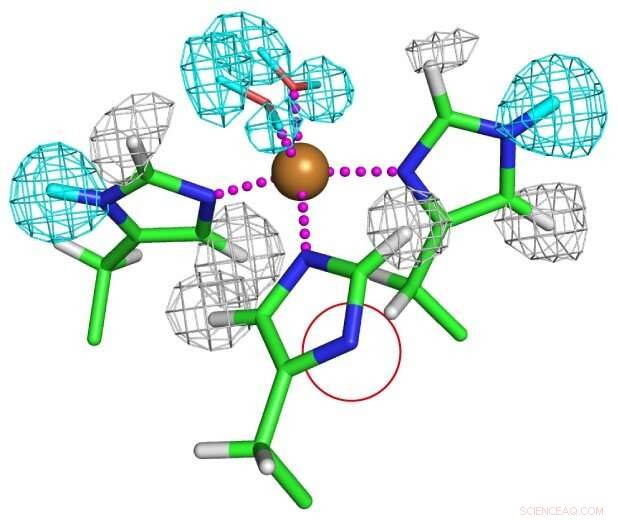
Protoneringstoestand van koper-gecoördineerde histidine-residuen. Een van de histidineresten is volledig gedeprotoneerd zoals weergegeven in een rode cirkel om een ongebruikelijk imidazolaatanion te vormen. Krediet:Universiteit van Osaka
De covalent aan het enzym gebonden topa-chinon-cofactor speelt een essentiële rol in de katalytische functie. De onderzoekers konden 30 jaar na de ontdekking ervan als een eiwit-afgeleide cofactor eindelijk een compleet beeld van topachinon krijgen. Ze ontdekten dat de cofactor eigenlijk in evenwicht bestaat tussen twee verschillende vormen.
"Enzym-actieve sites - waar de reacties plaatsvinden - kunnen ons veel informatie en inspiratie bieden als we volledig kunnen begrijpen wat er gebeurt, " legt Okajima uit. "Onze demonstratie van het gebruik van neutronenkristallografie om protonkwantumeffecten te ontdekken, belooft zeer nuttig te zijn voor veel onderzoekers die enzymen en hun mechanismen bestuderen."
 Wat zijn de zwakheden van kakkerlakken?
Wat zijn de zwakheden van kakkerlakken?  Hoe worden vulkanenuitbarstingen gemeten?
Hoe worden vulkanenuitbarstingen gemeten?  Vergelijking van klimaatsimulaties met proxies suggereert dat Arctisch zee-ijs in de zomer eerder dan verwacht zou kunnen verdwijnen
Vergelijking van klimaatsimulaties met proxies suggereert dat Arctisch zee-ijs in de zomer eerder dan verwacht zou kunnen verdwijnen Voor het eerst tornado's op Britse koude fronten voorspellen
Voor het eerst tornado's op Britse koude fronten voorspellen Dubbelzinnige toezeggingen zorgen voor grote onzekerheid onder klimaatakkoord van Parijs
Dubbelzinnige toezeggingen zorgen voor grote onzekerheid onder klimaatakkoord van Parijs
Hoofdlijnen
- Onderzoekers ontdekken nieuwe manier om met stress om te gaan
- Neuron: definitie, structuur, functie en types
- Hoge opbrengst, eiwit met sojabonengen
- Osmosis Feiten voor kinderen
- Europese zeebaars vertoont chronische verslechtering na blootstelling aan ruwe olie
- Stadia van een typische celcyclus
- Het belang van diffusie in organismen
- Wetenschapsprojecten: roken en de effecten ervan op de longen
- Nieuw onderzoek onthult de enige tuimelaars in Engeland
- Waterstofionen gebruiken om magnetisme op moleculaire schaal te manipuleren

- Uw koelkast op zonne-energie laten werken

- Natuurkundigen laten zien dat het onmogelijk is om kwantuminformatie in correlaties te maskeren

- Wetenschappers verbeteren het vermogen om elektrische eigenschappen van plasma te meten

- De vormen van atomaire clusters bepalen

 10 soorten fysieke verandering
10 soorten fysieke verandering  Lawinestatistieken suggereren dat Tabbys ster bijna een continue faseovergang heeft
Lawinestatistieken suggereren dat Tabbys ster bijna een continue faseovergang heeft Storing schakelt Google Agenda uit op desktopcomputers
Storing schakelt Google Agenda uit op desktopcomputers Wanneer het spelen van favorieten de groei kan schaden
Wanneer het spelen van favorieten de groei kan schaden Ideeën voor celademhaling
Ideeën voor celademhaling Amazon breidt aanwezigheid in de echte wereld uit
Amazon breidt aanwezigheid in de echte wereld uit Zoete ontdekking:nieuwe studie verdringt de oorsprong van chocolade
Zoete ontdekking:nieuwe studie verdringt de oorsprong van chocolade Hoe Afrikaanse feministen de vrede helpen handhaven tijdens een pandemie
Hoe Afrikaanse feministen de vrede helpen handhaven tijdens een pandemie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

