Wetenschap
Nieuwe methode voor het analyseren van metalloproteïnen
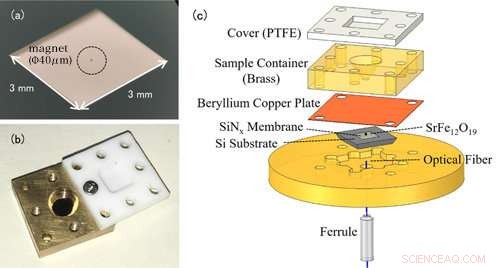
Figuur 1:(a) Foto van een nanomembraan. Het nanomembraan zelf is erg dun (100 nm), dus het lijkt transparant voor het blote oog. Het item in het midden is een kleine magneet voor EPR-detectie. (b) Foto van de oplossingscel. De container is bedekt met een Teflon-deksel om te voorkomen dat het oplossingsmonster verdampt. (c) De experimentele opstelling van de kracht-gedetecteerde EPR-spectroscopie. De oplossingscel met het meetmonster wordt boven het membraan geplaatst met daaraan bevestigde magneten. Veranderingen in het nanomembraan worden gedetecteerd door de optische vezel onder het membraan. Krediet:Universiteit van Kobe
Onderzoekers hebben een nieuwe methode ontwikkeld om metalloproteïnen te analyseren met slechts een klein vloeibaar monster. Deze doorbraak werd bereikt door een onderzoeksteam onder leiding van universitair hoofddocent Eiji Ohmichi en Tsubasa Okamoto aan de Kobe University Graduate School of Science. De bevindingen werden op 28 november gepubliceerd in Technische Natuurkunde Brieven .
Metalloproteïnen (ook bekend als metaalbindende eiwitten) spelen een vitale rol bij het transport en de opslag van zuurstof, elektronen transport, oxidatie en reductie. Vaak, de metaalionen in deze eiwitten zijn de actieve centra voor deze activiteiten, dus door de exacte toestand van deze ionen te identificeren, we kunnen de mechanismen achter hun functies begrijpen.
Een experimentele methode genaamd elektron paramagnetische resonantie (EPR) kan worden gebruikt om de toestand van elektronenionen in eiwitten te meten. Effectieve EPR-technieken vereisen een bepaalde hoeveelheid monstervolume voor gevoelige metingen. Echter, veel metalloproteïnen zijn moeilijk te isoleren en te verfijnen, dus onderzoekers kunnen alleen kleine steekproeven verkrijgen.
Conventionele EPR-metingen detecteren de elektromagnetische golven die worden geabsorbeerd door metaalionen. Het opvallende kenmerk van deze studie is het gebruik van een trampoline-vormig apparaat dat een nanomembraan wordt genoemd (figuur 1(a)). In EPR, de elektronspin gaat over in een toestand van hoge energie door elektromagnetische golven te absorberen, maar op het zelfde moment, de draairichting keert om, en de magnetische eigenschappen van de metaalionen veranderen ook. Voorafgaand aan het experiment, het onderzoeksteam bevestigde kleine magneten aan het nanomembraan, dus de veranderingen in de aantrekkingskracht tussen de magneten en de metaalionen worden omgezet in een kracht op het nanomembraan, en dit EPR-signaal wordt gedetecteerd. Omdat het nanomembraan erg dun is - slechts 100 nm (=0,1 m) kunnen we kleine veranderingen in kracht die gepaard gaan met EPR-absorptie gevoelig meten.
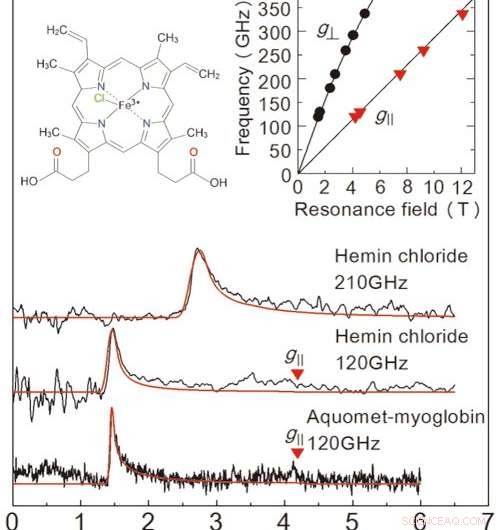
Figuur 2:resultaten van de EPR-metingen die in deze studie zijn verkregen uit een bevroren oplossingsmonster. De bovenste twee diagrammen zijn voor heminechloride, en de grafiek onderaan is voor myoglobine. De rode lijn is een geprojecteerd signaal van een waardesimulator. De oplossingsconcentraties en monstervolumes waren 50 mM、2 μL voor heminechloride, en 8,8 mM、10 μL voor myoglobine. Metingen vonden plaats bij 4,2 K. Door de twee lijnen in de grafiek rechtsboven te bekijken, kunnen we de exacte toestand van ijzerionen bepalen. De grafiek linksboven toont de moleculaire structuur van heminechloride. Krediet:Universiteit van Kobe
Het oplossingsmonster wordt in een oplossingscel direct boven het membraan geplaatst (figuur 1(b)). Het celvolume is slechts 50μL (=0,05 cc), en het team voegt ongeveer 1-10μL (0,001-0,01 cc) oplossing toe voor metingen. Om te voorkomen dat de oplossing verdampt, de cel is bedekt met een deksel van hars. Bij deze methode is het dunne en fragiele nanomembraan onafhankelijk van de oplossingscel, waardoor het gemakkelijk is om van specimen te wisselen (figuur 1(c)).
Om de prestaties van deze opstelling te evalueren, het team voerde EPR-metingen uit over een hoge frequentie (meer dan 0,1 THz) voor een ijzerbevattend eiwit genaamd myoglobine en zijn modelcomplex heminechloride (figuur 2). Het team slaagde erin EPR-signalen te detecteren over een brede golffrequentie (0,1-0,35 THz) voor een concentratie van 50 mM, 2μL heminechloride-oplossing. Ze observeerden ook een karakteristiek EPR-signaal voor een 8,8 mM, 10μL monster van myoglobine-oplossing. Een groot voordeel van deze methode is de mogelijkheid om over een breed frequentiebereik te meten, waardoor het toepasbaar is voor metalloproteïnen met een verscheidenheid aan magnetische eigenschappen.
Professor Ohmichi merkt op:"Deze nieuwe methode maakt het mogelijk om tot op een gedetailleerd niveau de toestand van de metaalionen in een kleine hoeveelheid metalloproteïne-oplossing te bepalen. Mogelijk kunnen we de methode toepassen op metalloproteïnen die voorheen niet konden worden gemeten. Bijvoorbeeld , in onze stofwisseling, een metalloproteïne genaamd peroxidase speelt een cruciale rol door waterstofperoxide om te zetten in water, onschadelijk maken, maar de details van het mechanisme voor dit reactieve proces zijn nog onduidelijk. De resultaten van deze studie kunnen mogelijk worden toegepast als een toonaangevende analysemethode om licht te werpen op dit soort vitale fenomenen."
 Onderzoekers halen natuurlijk voorkomende melanine op grote schaal uit paddenstoelen
Onderzoekers halen natuurlijk voorkomende melanine op grote schaal uit paddenstoelen Een uitgebreide metabole kaart voor de productie van biogebaseerde chemicaliën
Een uitgebreide metabole kaart voor de productie van biogebaseerde chemicaliën Onderzoekers gebruiken microgolven om tekenen van uitdroging te meten
Onderzoekers gebruiken microgolven om tekenen van uitdroging te meten Nieuw ontwerp van roterende vloeistofreactor lost problemen op met huidige reactoren
Nieuw ontwerp van roterende vloeistofreactor lost problemen op met huidige reactoren Niobium gebruikt als katalysator in brandstofcel
Niobium gebruikt als katalysator in brandstofcel
 Het uitgedroogde zuidwesten van de VS krijgt uitstel terwijl smeltende sneeuw rivieren vult
Het uitgedroogde zuidwesten van de VS krijgt uitstel terwijl smeltende sneeuw rivieren vult Hoe je genuanceerde details krijgt aan de top van de wereld
Hoe je genuanceerde details krijgt aan de top van de wereld NASA vindt beperkte waterdamp als depressie 06E een dal wordt
NASA vindt beperkte waterdamp als depressie 06E een dal wordt Hoe Cherry Cherry Trees te identificeren
Hoe Cherry Cherry Trees te identificeren Wetenschapper verwacht doorbraak in Antarctische zoektocht naar oudste ijs van planeten
Wetenschapper verwacht doorbraak in Antarctische zoektocht naar oudste ijs van planeten
Hoofdlijnen
- Onderzoekers ontdekken nieuwe manier om met stress om te gaan
- Wetenschappers roepen op tot actie om de dreiging van invasieve boomsoorten voor een wereldwijde hotspot voor biodiversiteit aan te pakken
- Herstel van iconische inheemse vogel veroorzaakt problemen in stedelijke gebieden
- Masterchef-techniek blijkt levensreddend te zijn voor bedreigde zeeschildpadeieren
- Hoe Punnett Squares
- Welke organellen zijn membraansusjes die worden gebruikt om moleculen te transporteren?
- GMO-experimenten
- Muizen in sociale conflicten vertonen gedrag dat zich aan regels houdt
- Wie heeft klonen bedacht en wanneer?
 Wie was James Webb?
Wie was James Webb?  Bouwmaterialen gebruiken om te controleren op hoogverrijkt uranium
Bouwmaterialen gebruiken om te controleren op hoogverrijkt uranium Reproductie, van Hippocrates tot IVF
Reproductie, van Hippocrates tot IVF Hoe reageert je immuunsysteem op nanomedicine?
Hoe reageert je immuunsysteem op nanomedicine? Nieuwe planningstool voor landgebruik voor boeren
Nieuwe planningstool voor landgebruik voor boeren Beleggers ontvluchten Bayer na tweede glyfosaat-proefslag (update)
Beleggers ontvluchten Bayer na tweede glyfosaat-proefslag (update) Hoe Parabolas op een TI-84 Calculator te plotten
Hoe Parabolas op een TI-84 Calculator te plotten Verhoogde bruikbaarheid en precisie bij vasculaire beeldvorming
Verhoogde bruikbaarheid en precisie bij vasculaire beeldvorming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com