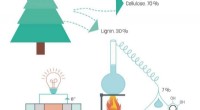
Wetenschap
Wat is zelfcondensatie van aminozuren?
* aminozuren vormen voornamelijk peptidebindingen: De meest voorkomende reactie met aminozuren is de vorming van peptidebindingen, waarbij de carboxylgroep van het ene aminozuur reageert met de aminogroep van een ander. Dit proces wordt gekatalyseerd door ribosomen en is fundamenteel voor eiwitsynthese.
* Zelfverdensie is energetisch ongunstig: Voor een enkel aminozuur om zelfverdenkingen te ondergaan, zou de carboxylgroep moeten reageren met zijn eigen aminogroep. Deze reactie is zeer ongunstig omdat:
* sterische hindering: De amino- en carboxylgroepen zijn dicht bij elkaar, waardoor het voor hen moeilijk is om te reageren.
* Ongunstige thermodynamica: De reactie vereist het verwijderen van een watermolecuul, dat energetisch ongunstig is.
* Aanwezigheid van andere aminozuren: In biologische systemen zijn aminozuren zelden afzonderlijk aanwezig. Ze worden meestal aangetroffen in complexe mengsels, waardoor zelfverdenkingen nog minder waarschijnlijk zijn.
Er zijn echter enkele uitzonderingen:
* Dipeptide -vorming: Onder specifieke omstandigheden kunnen sommige aminozuren dipeptiden vormen door zelfcondensatie. Dit komt meestal voor in laboratoriumomgevingen met hoge concentraties van een enkel aminozuur en het gebruik van specifieke katalysatoren.
* cyclische peptiden: Sommige cyclische peptiden kunnen worden gevormd door zelfverdenkingsreacties met de aminogroep en de zijketen van hetzelfde aminozuur. Deze reacties worden vaak gekatalyseerd door enzymen.
Samenvattend: Hoewel aminozuren onder specifieke omstandigheden zelfcondensatie kunnen ondergaan, is het geen gemeenschappelijk of belangrijk proces in de context van standaard biochemie. Peptidebindingsvorming tussen verschillende aminozuren is het primaire mechanisme voor eiwitsynthese.
 Kleurveranderende contactlenzen kunnen de monitoring van oogziektebehandelingen verbeteren
Kleurveranderende contactlenzen kunnen de monitoring van oogziektebehandelingen verbeteren Wat toont de relatie tussen reactanten en producten in een chemische reactie?
Wat toont de relatie tussen reactanten en producten in een chemische reactie?  Nieuwe materialen verbeteren de levering van therapeutisch boodschapper-RNA
Nieuwe materialen verbeteren de levering van therapeutisch boodschapper-RNA Waar zijn de 92 basisstoffen waaraan alle materie van is gemaakt?
Waar zijn de 92 basisstoffen waaraan alle materie van is gemaakt?  Welke naam wordt gebruikt voor materialen die de warmte niet goed laten doorgaan?
Welke naam wordt gebruikt voor materialen die de warmte niet goed laten doorgaan?
 Bodememissies in Central Valley een grote bron van vervuiling door stikstofoxiden
Bodememissies in Central Valley een grote bron van vervuiling door stikstofoxiden Theorie van niet-orthogonalisatie en ruimtelijke lokalisatie voor convectie-toelatende ensemble-voorspelling
Theorie van niet-orthogonalisatie en ruimtelijke lokalisatie voor convectie-toelatende ensemble-voorspelling Stedelijke vervuiling versterkt tot 400% vorming van aerosolen boven het Amazone-regenwoud
Stedelijke vervuiling versterkt tot 400% vorming van aerosolen boven het Amazone-regenwoud Oklahomas Environmental Problems
Oklahomas Environmental Problems NASA onderzoekt tropische storm Fung-Wongs regenval
NASA onderzoekt tropische storm Fung-Wongs regenval
Hoofdlijnen
- Welke eigenschap van DNA maakt hybridisatie tussen een gelabelde sonde en doelgen mogelijk?
- Wat betekent neurobiologie?
- Wat is een dorsale wortel en wat voor soort neuron in deze structuur?
- De E. coli die normaal in de menselijke dikke darm leeft en vitamine K lichaamsgebruik produceert, zou het best worden genoemd?
- Welke zijn nuttige organismen in biotechnologie?
- Gebruikten Linnaeus overeenkomsten in structuur om relaties tussen organismen te bepalen?
- Het homeostatische mechanisme dat constant fluctueert, wordt het wat genoemd?
- Wat doet brood met het lichaamssysteem?
- Taxonomie is de wetenschap die zich bezighoudt?
 Afbeelding:Nederland in het wit
Afbeelding:Nederland in het wit Zou het idee over evolutie beschrijven?
Zou het idee over evolutie beschrijven?  Hoe noem je een verandering in de erfelijke instructies van een organisme?
Hoe noem je een verandering in de erfelijke instructies van een organisme?  Wat is de wetenschappelijke naam van DNA?
Wat is de wetenschappelijke naam van DNA?  De Apple-creditcard is er
De Apple-creditcard is er Hoe lang duurt een zonnecyclus?
Hoe lang duurt een zonnecyclus?  Wat zijn moleculen die opgeroepen zijn door enzymen die worden genoemd?
Wat zijn moleculen die opgeroepen zijn door enzymen die worden genoemd?  Welk gas geven groene planten af?
Welk gas geven groene planten af?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com