
Wetenschap
Waarom hebben metalen een vergelijkbare molaire warmtecapaciteit?
Dit is waarom dit gebeurt:
* gratis elektronenmodel: Metalen hebben een zee van vrije elektronen die energie kunnen absorberen en opslaan. Wanneer warmte wordt toegevoegd, krijgen deze elektronen kinetische energie en dragen ze aanzienlijk bij aan de algehele warmtecapaciteit van het metaal.
* trillingsmodi: De atomen in het metalen rooster trillen ook en deze trillingen absorberen ook energie. De bijdrage van vibratiemodi is echter over het algemeen minder significant dan die van vrije elektronen.
* Vergelijkbare structuur: De meeste metalen hebben een vergelijkbare kristalstructuur (bijv. Face-gecentreerde kubieke of lichaamsgerichte kubieke). Deze gelijkenis in structuur leidt tot vergelijkbare trillingsfrequenties en energieopslagcapaciteiten.
Uitzonderingen op Dulong-Petit Law:
Hoewel de Dulong-Petit-wet een goede benadering biedt, wijken sommige metalen af, met name bij lage temperaturen. Deze afwijkingen zijn te wijten aan factoren zoals:
* kwantumeffecten: Bij lage temperaturen worden kwantumeffecten aanzienlijk en worden de energieniveaus van de elektronen en atomen gekwantiseerd. Dit kan leiden tot een vermindering van de warmtecapaciteit.
* Specifieke warmtecapaciteit: Sommige metalen, zoals lithium en beryllium, hebben lagere molaire warmtecapaciteiten vanwege hun lichtere atoomgewichten.
Conclusie: De vergelijkbare molaire warmtecapaciteit van metalen is voornamelijk te wijten aan de aanwezigheid van vrije elektronen en de vergelijkbare structuur van hun roosters. Factoren zoals temperatuur en specifieke warmtecapaciteit kunnen echter de afwijking van de Dulong-Petit-wet beïnvloeden.
 Wat is de enkele stapvoorbereiding van heterocyclische verbinding?
Wat is de enkele stapvoorbereiding van heterocyclische verbinding?  Hoe wordt het genoemd als Atom een positieve of negatieve lading heeft?
Hoe wordt het genoemd als Atom een positieve of negatieve lading heeft?  Wat verklaart de samendrukbaarheid van gassen in vergelijking met vloeistoffen en vaste stoffen?
Wat verklaart de samendrukbaarheid van gassen in vergelijking met vloeistoffen en vaste stoffen?  Wat is een pure substantie die uit slechts één type atoom bestaat?
Wat is een pure substantie die uit slechts één type atoom bestaat?  Hoe noem je de materialen waarmee elektronen kunnen stromen?
Hoe noem je de materialen waarmee elektronen kunnen stromen?
 NASA's Aqua Satellite vindt Dumazile geschoren
NASA's Aqua Satellite vindt Dumazile geschoren Onbeleefdheid vermindert de belangstelling voor wat politici te zeggen hebben, zo blijkt uit onderzoek
Onbeleefdheid vermindert de belangstelling voor wat politici te zeggen hebben, zo blijkt uit onderzoek  Iteratieve evolutie:is de Aldabra Rail tweemaal geëvolueerd?
Iteratieve evolutie:is de Aldabra Rail tweemaal geëvolueerd?  Hoe beïnvloedt de wetenschap ons?
Hoe beïnvloedt de wetenschap ons?  Ontbossing kan de bosbranden in het Amazonewoud elk jaar verergeren
Ontbossing kan de bosbranden in het Amazonewoud elk jaar verergeren
Hoofdlijnen
- Tsunami onthult menselijke geluidsoverlast in Hawaiiaanse wateren
- Wat is er te vinden in de cisternae van RER?
- Wat zijn de kenmerken van evolutie?
- Hoe noem je ronde clusters van coccusbacteriën?
- Waar komen Australische katten vandaan?
- Wat betekent het woord dominant in genetica?
- Welke structuur leidt de activiteiten van een cel?
- Wat is in staat tot evolutie?
- Wat is de vorm van menselijke huidcellen onder microscoop?
- Een radicale benadering van methaanoxidatie tot methanol
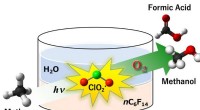
- Wetenschappers ontdekken nieuwe chemische reactie

- Video:Heldinnen van het periodiek systeem

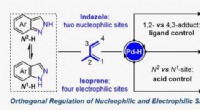
- Orthogonale regulatiestrategie biedt nieuwe kansen voor opbouw van moleculaire complexiteit
- In enkele seconden vlees- en visfraude aan het licht brengen met een draagbare MasSpec-pen

 Wat is een afgeleide UNTIT?
Wat is een afgeleide UNTIT?  Welke energie verhoogt de hoogte?
Welke energie verhoogt de hoogte?  Nieuw materiaal met magnetisch vormgeheugen
Nieuw materiaal met magnetisch vormgeheugen De meeste zonne -energie die atmosfeer bereikt, wordt opgenomen door WHTAT?
De meeste zonne -energie die atmosfeer bereikt, wordt opgenomen door WHTAT?  Wat is de molaliteit van een oplossing die 1330G methanol en 16,6 g natriumbromide bevat?
Wat is de molaliteit van een oplossing die 1330G methanol en 16,6 g natriumbromide bevat?  Kristallen deurknoppen identificeren
Kristallen deurknoppen identificeren Wat zijn de enige twee soorten cellen met exciteerbare membranen?
Wat zijn de enige twee soorten cellen met exciteerbare membranen?  Wat is het vegetatiegebied dat bergop wordt gevonden uit een stroom die wordt genoemd?
Wat is het vegetatiegebied dat bergop wordt gevonden uit een stroom die wordt genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap & Ontdekkingen © https://nl.scienceaq.com

