
Wetenschap
Hebben moleculen in een vloeistof dezelfde kinetische energie als gas?
Dit is waarom:
* Kinetische energie en temperatuur: Kinetische energie is recht evenredig met de temperatuur. Dit betekent dat moleculen bij dezelfde temperatuur in zowel vloeistoffen als gassen dezelfde gemiddelde kinetische energie hebben.
* intermoleculaire krachten: Het belangrijkste verschil ligt in de sterkte van intermoleculaire krachten . Vloeistoffen hebben sterkere intermoleculaire krachten dan gassen. Deze krachten beperken de beweging van vloeibare moleculen, waardoor ze lagere kinetische energie hebben dan gasmoleculen bij dezelfde temperatuur.
in eenvoudiger termen:
Stel je gasmoleculen voor als kleine, energetische knikkers die vrij stuiteren. Vloeibare moleculen zijn als die knikkers, maar ze zijn ook vastgehouden met lijm (de intermoleculaire krachten). Hoewel ze trillen en bewegen, kunnen ze niet zo vrij bewegen als de gasmoleculen.
Daarom, hoewel de gemiddelde kinetische energie van vloeistof en gasmoleculen bij dezelfde temperatuur hetzelfde is, hebben de individuele moleculen in de vloeistof een lagere kinetische energie vanwege de sterkere intermoleculaire krachten.
 Identificatie van hormoonontregelaars die worden belemmerd door gegevensschaarste:rapport
Identificatie van hormoonontregelaars die worden belemmerd door gegevensschaarste:rapport  Wat wordt geproduceerd wanneer waterstof en zuurstof samen reageren?
Wat wordt geproduceerd wanneer waterstof en zuurstof samen reageren?  Eindelijk synthetisch canataxpropellane:een van de meest complexe producten van de natuur reproduceren
Eindelijk synthetisch canataxpropellane:een van de meest complexe producten van de natuur reproduceren Zou water voor elke kleurstof een aanvulbaar oplosmiddel zijn?
Zou water voor elke kleurstof een aanvulbaar oplosmiddel zijn?  Welke indicatoren worden gebruikt bij redoxtitratie?
Welke indicatoren worden gebruikt bij redoxtitratie?
 De ergste vervuilers in het Noordpoolgebied zijn niet wat je denkt
De ergste vervuilers in het Noordpoolgebied zijn niet wat je denkt  Epische droogte betekent watercrisis aan de grens tussen Oregon en Californië
Epische droogte betekent watercrisis aan de grens tussen Oregon en Californië Onderzoekers ontwikkelen genetisch hulpmiddel om arseenstudies te verbeteren
Onderzoekers ontwikkelen genetisch hulpmiddel om arseenstudies te verbeteren Wat is het tegenovergestelde van het polaire klimaat?
Wat is het tegenovergestelde van het polaire klimaat?  Reactieve halogeen van huishoudelijke kolenverbranding verergert de luchtvervuiling in de winter
Reactieve halogeen van huishoudelijke kolenverbranding verergert de luchtvervuiling in de winter
Hoofdlijnen
- Hoe belangrijk is dieronderzoek naar de medische wetenschap geweest?
- Wat zijn de soorten cellulaire
- Hoe noem je het eerste deel zichtbaar na een zaadkiemt en wat is de functie?
- Wetenschappers onthullen hoe muizen elkaar herkennen
- Vechten tegen bubbels:hoe planten zichzelf beschermen tegen dodelijke schimmels
- Welke stoffen helpen de lichaamsfuncties te reguleren?
- Wat is wetenschappelijke hypothesen?
- Wat is de epidermale cel die een rol speelt in immuniteit en ziektebestendigheid?
- Organismen hebben over het algemeen veel genen die zich onafhankelijk bevatten dan het aantal van hun chromosomen waaraan dit fenomeen te wijten is?
- Keramische membranen scheiden kleine organische moleculen met een molecuulmassa van 200 Dalton

- Metalen organische kaders metalen meesterschap

- Onderzoekers ontwikkelen 3D-printsubstraat met dynamische bindingen voor instelbare eigenschappen

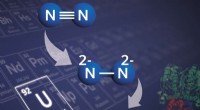
- Een op uranium gebaseerde verbinding verbetert de productie van stikstofproducten
- De vorm van zachte materie veranderen met behulp van logische circuits gemaakt van DNA
 Waar is het cursief voor, neem dan een liter van deze droge haver?
Waar is het cursief voor, neem dan een liter van deze droge haver?  Wat is de zuurgraad van waterstofchloride?
Wat is de zuurgraad van waterstofchloride?  Welk land heeft de Astrolabe uitgevonden?
Welk land heeft de Astrolabe uitgevonden?  Wat is het proces door welke fragmenten in de ruimte samen worden getrokken om planeten te vormen?
Wat is het proces door welke fragmenten in de ruimte samen worden getrokken om planeten te vormen?  Wat is het proces van een erts?
Wat is het proces van een erts?  Reizen door het lichaam met grafeen
Reizen door het lichaam met grafeen Waarom worden er op sommige plaatsen zoveel talen gesproken en op andere zo weinig?
Waarom worden er op sommige plaatsen zoveel talen gesproken en op andere zo weinig? De drie niveaus van de natuurwetenschappen
De drie niveaus van de natuurwetenschappen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

