
Wetenschap
Hoe verspreiden twee gassen zich door elkaar?
1. De drijvende kracht:concentratiegradiënt
* gassen gaan van nature van gebieden met een hoge concentratie naar gebieden met een lage concentratie. Stel je twee containers voor, één gevuld met zuurstof en de andere met stikstof. Als u een doorgang tussen hen opent, zal zuurstof naar de met stikstof gevulde container gaan en stikstof in de met zuurstof gevulde container. Deze beweging gaat door totdat de concentratie van beide gassen gelijkmatig is verdeeld.
2. Willekeurige beweging
* gasmoleculen zijn constant in willekeurige beweging. Ze botsen met elkaar en met de muren van hun container. Deze constante beweging is wat diffusie drijft.
3. De rol van intermoleculaire krachten
* intermoleculaire krachten tussen gasmoleculen zijn erg zwak. Hierdoor kunnen de moleculen zich vrij en gemakkelijk verplaatsen over de ruimte die ze innemen.
* Hoe zwakker de intermoleculaire krachten, hoe sneller de diffusie. Dit is de reden waarom lichtere gassen zoals waterstof sneller diffunderen dan zwaardere gassen zoals koolstofdioxide.
4. Factoren die de diffusiesnelheid beïnvloeden:
* concentratiegradiënt: Hoe groter het verschil in concentratie tussen de twee gassen, hoe sneller de diffusie.
* Temperatuur: Hogere temperaturen betekenen snellere moleculaire beweging, wat leidt tot snellere diffusie.
* Molecuulgewicht: Lichtere moleculen diffunderen sneller dan zwaardere moleculen.
* oppervlakte: Een groter oppervlak zorgt voor meer contact tussen de gassen, wat leidt tot snellere diffusie.
Samenvattend:
Diffusie is een fundamenteel proces waarmee gassen zich over hun omgeving kunnen mengen en zich verspreiden. De drijvende kracht is de concentratiegradiënt en de willekeurige beweging van gasmoleculen, aangedreven door zwakke intermoleculaire krachten, maakt diffusie mogelijk. De diffusiesnelheid wordt beïnvloed door factoren zoals temperatuur, molecuulgewicht en oppervlakte.
Hoofdlijnen
- Wat is de ultieme oorzaak van vooringenomenheid in de wetenschap?
- Noem het wetenschappelijke woord voor suikerwater?
- Welke soorten gegevens kunnen in een experiment worden verzameld?
- Welke systemen in het lichaam zijn gerelateerd?
- Welke stoffen hebben een netto beweging in de mitochondria?
- In welk deel van bloemen wordt pollen geproduceerd?
- Onderzoekers ontdekken hoe griepvirussen menselijke cellen kapen
- Is ademhaling de exacte omkering van biochemische paden fotosynthese?
- Wat is het behoud van dode organisme door te drogen?
- Het wateroppervlak is een fantastische plek voor chemische reacties

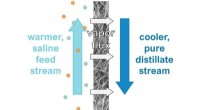
- Hoe maak je zout water beter schoon? Door ontziltingsgereedschappen droog te houden
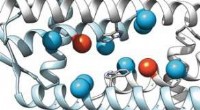
- Gerichte evolutie van een designer-enzym met een onnatuurlijk katalytisch aminozuur
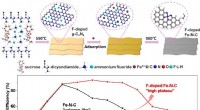
- Onderzoekers gebruiken de fluordopingmethode om katalysatoren te bouwen met verbeterde prestaties
- Gecko-adhesietechnologie komt dichter bij industrieel gebruik

 Is het waar of onwaar dat objecten ook massa hebben, ook een zwaartekracht die tussen hen werkt, ongeacht hoe ver ze zijn?
Is het waar of onwaar dat objecten ook massa hebben, ook een zwaartekracht die tussen hen werkt, ongeacht hoe ver ze zijn?  Wat als ziekte niet bestond?
Wat als ziekte niet bestond?  Hoe tanden bleken werkt
Hoe tanden bleken werkt  Wat is de energie van een kei die op Top Hill rust?
Wat is de energie van een kei die op Top Hill rust?  Onderzoek vindt op silicium gebaseerde, tandem fotovoltaïsche modules kunnen concurreren op de zonnemarkt
Onderzoek vindt op silicium gebaseerde, tandem fotovoltaïsche modules kunnen concurreren op de zonnemarkt Een afzetting van los materiaal gedragen en achtergelaten door een gletsjer?
Een afzetting van los materiaal gedragen en achtergelaten door een gletsjer?  Nieuwe mutaties in iPS-cellen zijn voornamelijk geconcentreerd in niet-transcriptionele regio's
Nieuwe mutaties in iPS-cellen zijn voornamelijk geconcentreerd in niet-transcriptionele regio's Wat is de enige voedingsstof die elementstikstof bevat?
Wat is de enige voedingsstof die elementstikstof bevat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


