
Wetenschap
Gerichte evolutie van een designer-enzym met een onnatuurlijk katalytisch aminozuur
Krediet:Wiley
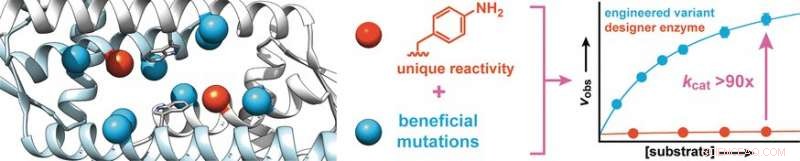
De indrukwekkend hoge conversiepercentages van natuurlijke enzymen zijn deels het gevolg van het verhogen van de katalytische activiteit van een aantal geselecteerde aminozuurzijketens door nauwkeurige positionering in de eiwitbindende holte. Wetenschappers hebben nu aangetoond dat een dergelijke fijnafstemming ook mogelijk is voor "designer"-enzymen met onnatuurlijke katalytische aminozuren. In het journaal Angewandte Chemie , zij melden dat laboratorium "evolutie" van een designer enzym met een aniline zijketen leidde tot varianten met een significant hogere activiteit.
De snelheid en selectiviteit waarmee enzymen in de natuur omzettingen katalyseren zijn benijdenswaardig. Om onnatuurlijke reacties katalytisch te stimuleren, onderzoekers bootsen enzymen na met behulp van eiwitraamwerken die zijn gerealiseerd door computerondersteund eiwitontwerp. Verdere optimalisatie wordt bereikt door herhaling van een darwinistische cyclus:1) diversificatie door mutatie, 2) identificatie van verbeterde katalysatoren, en 3) amplificatie van de efficiëntere enzymvarianten. Dit zorgt voor de productie van designer enzymen met zeer hoge activiteiten.
Onderzoekers onder leiding van Clemens Mayer en Gerard Roelfes van de Rijksuniversiteit Groningen (Nederland) hebben nu aangetoond dat dit soort gerichte evolutie ook een methode is om de efficiëntie van een nieuwe klasse designer-enzymen te verbeteren:enzymen die een aminozuur bevatten dat door de natuur niet gebruikt.
Beginnend met een eiwit van Lactococcus lactis, een bacterie die wordt gebruikt bij de productie van zuivelproducten zoals kaas en karnemelk, de onderzoekers synthetiseerden een designerenzym dat een aminozuur bevat met een abiotische anilinezijketen (aminofenylalanine). Zoals gratis aniline, dit aminozuur katalyseert de reactie van aldehyden met hydrazinen of hydroxylaminen om hydrazonen of oximen te maken, respectievelijk.
Om de activiteit van het enzym te verhogen, de onderzoekers maakten enzymvarianten met mutaties op aminozuren nabij de anilinezijketen. Screening van ongeveer 400 mutanten leverde twee kandidaten op met een betere activiteit, waarvan er één werd onderworpen aan een tweede evolutionaire ronde. Dit leidde tot de ontdekking van meer gunstige mutaties. Om synergetische effecten te identificeren, meerdere gunstige mutaties werden gecombineerd om verdere varianten te produceren. Op deze manier, het was mogelijk om de conversiesnelheid van het enzym met een factor 90 te verhogen.
De onderzoekers benadrukken dat, verwant aan natuurlijke enzymen, "Deze drastische toename is gebaseerd op het versterken van de inherente katalytische activiteit van de anilinezijketen. We zijn van plan dit principe te gebruiken om verdere organische katalysatoren als zijketens in enzymen op te nemen, en om gerichte evolutie te gebruiken om deze om te zetten in zeer effectieve designer-enzymen die snel en efficiënt synthetisch belangrijke reacties kunnen uitvoeren die anders maar heel langzaam zouden verlopen."
 Stabiele toevoer van elektrochroom metallo-supramoleculaire polymeer
Stabiele toevoer van elektrochroom metallo-supramoleculaire polymeer Hiërarchisch mesoporeuze titaniumdioxidematerialen voor energie- en milieutoepassingen
Hiërarchisch mesoporeuze titaniumdioxidematerialen voor energie- en milieutoepassingen Onderzoekers gebruiken jiggly Jell-O om krachtige nieuwe waterstofbrandstofkatalysator te maken
Onderzoekers gebruiken jiggly Jell-O om krachtige nieuwe waterstofbrandstofkatalysator te maken Goedkope detector is als klittenband voor kankercellen
Goedkope detector is als klittenband voor kankercellen Röntgenfoto's van menselijke schedel om militaire helmen te verbeteren
Röntgenfoto's van menselijke schedel om militaire helmen te verbeteren
 Prehistorische veranderingen in vegetatie helpen de toekomst van ecosystemen op aarde te voorspellen
Prehistorische veranderingen in vegetatie helpen de toekomst van ecosystemen op aarde te voorspellen VN-rapport zegt dat kwetsbaar klimaat voedselzekerheid in gevaar brengt
VN-rapport zegt dat kwetsbaar klimaat voedselzekerheid in gevaar brengt Wat is de Forest Stewardship Council-certificering?
Wat is de Forest Stewardship Council-certificering?  Magma modelleren om koper te vinden
Magma modelleren om koper te vinden Massaal hout:groot denken over duurzaam bouwen
Massaal hout:groot denken over duurzaam bouwen
Hoofdlijnen
- Projectideeën om het menselijk spijsverteringssysteem op de middelbare school voor studenten te laten zien
- Schapen kunnen menselijke gezichten van foto's herkennen
- Interne krachten die celmigratie sturen, worden onthuld door microscopie met levende cellen
- 7 soorten bindweefsel
- Je wandeling is zo duidelijk dat het diepe persoonlijkheidskenmerken kan onthullen
- Satellietvolging geeft aanwijzingen over verloren jaren aan Zuid-Atlantische zeeschildpadden
- Wat zijn de vijf klassen van immunoglobulinen?
- Gedachtenexperiment:wat is ons transhumane pad voorbij de aarde?
- Wat zijn de vier belangrijkste methoden voor het produceren van ATP?
- Zeolietkatalysatoren effenen de weg naar decentrale chemische processen

- Voeg gewoon water toe:een eenvoudige stap verhoogt het vermogen van polymeren om koolstofdioxide uit gemengde gassen te filteren

- In de brandstofcel:beeldvormingsmethode belooft industrieel inzicht

- Nieuw gekleurd coatingoppervlak voor superieure roestbestendigheid

- Kracht voor de toekomst met revolutionaire lithiumextractietechniek
 Naar de maan kijken om klimaatverandering op aarde beter te meten
Naar de maan kijken om klimaatverandering op aarde beter te meten Lezen tussen de diamanten:wetenschappers breiden diep koolstofverhaal uit
Lezen tussen de diamanten:wetenschappers breiden diep koolstofverhaal uit Zeven kastelen en tellen:Chinese miljardair is groot in Bordeaux
Zeven kastelen en tellen:Chinese miljardair is groot in Bordeaux Industrieconcentratie draagt bij aan erosie van de arbeidskwaliteit, loonstagnatie
Industrieconcentratie draagt bij aan erosie van de arbeidskwaliteit, loonstagnatie Klimaateffecten zorgen voor een oost-west kloof in de productie van boszaad
Klimaateffecten zorgen voor een oost-west kloof in de productie van boszaad Wat is de functie van een kleidriehoek?
Wat is de functie van een kleidriehoek?  In vivo fotoakoestische computertomografie met superresolutie door lokalisatie van enkelgekleurde druppeltjes
In vivo fotoakoestische computertomografie met superresolutie door lokalisatie van enkelgekleurde druppeltjes Opnieuw uitgevonden thermionische energietechnologie om de elektriciteitskosten te verlagen
Opnieuw uitgevonden thermionische energietechnologie om de elektriciteitskosten te verlagen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

