
Wetenschap
Waarom absorberen en herschikken geëxciteerde atombs straling bij karakteristieke frequenties?
1. Gekwantiseerde energieniveaus:
* Elektronen in een atoom kunnen alleen specifieke energieniveaus bezetten, die worden gekwantiseerd. Dit betekent dat ze alleen kunnen bestaan op discrete energiewaarden, zoals stappen op een ladder.
* Het verschil in energie tussen deze niveaus wordt de energiekloof genoemd.
2. Absorptie van straling:
* Wanneer een atoom een foton van licht absorbeert, springt het elektron van een lager energieniveau naar een hoger.
* De energie van het geabsorbeerde foton moet precies overeenkomen met de energiekloof tussen de twee niveaus om deze overgang te laten plaatsvinden.
* Dit is de reden waarom alleen specifieke stralingsfrequenties kunnen worden geabsorbeerd, overeenkomend met de toegestane energieverboorzers in het atoom.
3. Emissie van straling:
* Een opgewonden atoom, met een elektron in een hoger energieniveau, is onstabiel.
* Om terug te keren naar een lager energieniveau, moet het elektron de overtollige energie vrijgeven.
* Deze energie wordt vrijgegeven als een foton van licht, met een frequentie bepaald door het energieverschil tussen de twee niveaus.
* Dit proces staat bekend als emissie.
4. Karakteristieke frequenties:
* Omdat de energieniveaus binnen elk atoom uniek zijn, zijn de energiekloven en overeenkomstige frequenties van absorptie en emissie ook kenmerkend voor dat specifieke atoom.
* Dit is de reden waarom elk element een unieke spectrale handtekening heeft, gebaseerd op de specifieke lichtfrequenties die het absorbeert en uitzendt.
Analogie:
Stel je een ladder voor met sporten die energieniveaus vertegenwoordigen. Een foton van licht is als een stap. Het elektron kan alleen omhoog of door de ladder bewegen door een specifieke stap te zetten die overeenkomt met de energie van het foton. De grootte van de stappen (energiekloven) bepaalt de frequentie van het opgenomen of uitgestoten licht.
Conclusie:
De karakteristieke frequenties van absorptie en emissie door geëxciteerde atomen zijn een gevolg van de gekwantiseerde aard van energieniveaus in atomen, waardoor alleen specifieke energieverzochten en overeenkomstige fotonenergieën mogelijk zijn. Deze unieke spectrale vingerafdruk wordt gebruikt in verschillende toepassingen, waaronder spectroscopie voor het identificeren van elementen en het bestuderen van hun eigenschappen.
 De samengestelde BA (NO3) 2 omvat zuurstofatomen. 6 3 5 2?
De samengestelde BA (NO3) 2 omvat zuurstofatomen. 6 3 5 2?  Welk materiaal heeft een dichtheid van 1,2?
Welk materiaal heeft een dichtheid van 1,2?  Welk element is een goede geleider van elektriciteit? Het vormt ook chloride in de vorm XCl2 en een oxide XO. De vloeistof bij kamertemperatuur. Welke identiteit?
Welk element is een goede geleider van elektriciteit? Het vormt ook chloride in de vorm XCl2 en een oxide XO. De vloeistof bij kamertemperatuur. Welke identiteit?  Waarom is het oxidatiegetal van S in FeS2 -1?
Waarom is het oxidatiegetal van S in FeS2 -1?  Is K2-18b bedekt met oceanen van water of lava?
Is K2-18b bedekt met oceanen van water of lava?
 De hitte voelen:Tokio bereidt zich voor op de zinderende Olympische Zomerspelen
De hitte voelen:Tokio bereidt zich voor op de zinderende Olympische Zomerspelen Rapport:Effecten van klimaatverandering op inheemse volkeren, land en cultuur
Rapport:Effecten van klimaatverandering op inheemse volkeren, land en cultuur NASA-satelliet toont tyfoon Mitags groot bereik boven Oost-Chinese Zee
NASA-satelliet toont tyfoon Mitags groot bereik boven Oost-Chinese Zee Uit onderzoek blijkt dat de recente wereldwijde versnelling van de zeespiegel begon in de jaren zestig
Uit onderzoek blijkt dat de recente wereldwijde versnelling van de zeespiegel begon in de jaren zestig Hete zomers, intense brandseizoenen zaadzombiebranden:studie
Hete zomers, intense brandseizoenen zaadzombiebranden:studie
Hoofdlijnen
- Wat maakt een verhaal succesvol? Onderzoekers hebben een manier gevonden om dit te voorspellen
- Waar behoort de geschiedenis tot de takken van de wetenschap?
- Wat zijn nieuwe gencombinaties?
- De rol van microfilamenten in cytokinese
- Nieuw onderzoek benadrukt de noodzaak om te leren van klimaatveranderingen uit het verleden
- Wat is de primaire structuur voor het sorteren en verzenden van eiwitten die worden geëxporteerd van cel of invoeging in membraan?
- Wat zijn de kenmerken van een wetenschappelijk model?
- Waarom bepalen chromosomen het fenotype van een individu?
- Wat betekent groei van mevrouw Gren in de wetenschapsbeschrijving?
- Simulaties identificeren het belang van roostervervormingen in ionengeleidende brandstofcelmaterialen
- Doorbrekende symmetrie leidt tot responsieve organische fotodetectoren
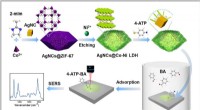
- Nieuwe SERS-sensor helpt bij het detecteren van aldehydegassen
- Chemici brengen gemengde gevouwen eiwitten tot leven

- Adsorberend materiaal ontwikkeld uit PET-flessen voor het verwijderen van antibiotica uit water
 Torsie berekenen Constant
Torsie berekenen Constant Wat is metallurgische cokes?
Wat is metallurgische cokes?  Is lichte energie een grondstof of eindproduct in fotosynthese?
Is lichte energie een grondstof of eindproduct in fotosynthese?  NASA ziet kleine tropische storm Vincente nabij de zuidwestelijke kust van Mexico
NASA ziet kleine tropische storm Vincente nabij de zuidwestelijke kust van Mexico Uit onderzoek blijkt hoe microplastics in de luchtwegen van mensen blijven hangen
Uit onderzoek blijkt hoe microplastics in de luchtwegen van mensen blijven hangen  3D-print een stukje Mars voor de feestdagen
3D-print een stukje Mars voor de feestdagen Al slecht af, alleenstaande ouders gingen dramatisch achteruit tijdens COVID
Al slecht af, alleenstaande ouders gingen dramatisch achteruit tijdens COVID Wat eet een marmot?
Wat eet een marmot?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

