
Wetenschap
Welke wetenschappers gebruikten atomaire spectra om een model van het atoom te ontwikkelen?
* niels bohr: In 1913 gebruikte Bohr de spectrale waterstoflijnen om zijn model van het atoom voor te stellen, waarbij elektronen de kern in specifieke energieniveaus draaien. Hij legde de spectrale lijnen uit door te stellen dat elektronen tussen energieniveaus konden springen door fotonen van licht te absorberen of uit te stoten.
* Johannes Rydberg: Vóór Bohr observeerde Rydberg patronen in de spectrale lijnen van waterstof en ontwikkelde een empirische formule om hun golflengten te voorspellen. Deze formule, nu bekend als de Rydberg -formule, speelde een belangrijke rol bij Bohr's ontwikkeling van zijn model.
* Joseph John Thomson: Terwijl Thomson's pruimpuddingmodel later werd vervangen door het model van Bohr, legde zijn ontdekking van het elektron en zijn werk aan de aard van kathodestralen de basis voor het begrijpen van de atoomstructuur.
* Max Planck: Hoewel niet direct betrokken bij atomaire modellen, was het werk van Planck aan de kwantumtheorie cruciaal voor het verklaren van het bestaan van discrete spectrale lijnen. Hij stelde voor dat energie wordt gekwantiseerd, wat betekent dat het alleen kan bestaan in specifieke pakketten genaamd Quanta.
Hoewel het model van Bohr een belangrijke doorbraak was, was dit niet het laatste woord over de atomaire structuur. Latere ontwikkelingen in de kwantummechanica, met name het werk van Erwin Schrödinger en Werner Heisenberg, leidden tot de ontwikkeling van het meer accurate en verfijnde model van het atoom dat we vandaag gebruiken.
Over het algemeen speelde de studie van atomaire spectra een cruciale rol in de ontwikkeling van ons begrip van het atoom. Het leverde bewijs voor het bestaan van gekwantiseerde energieniveaus en hielp ons begrip vorm te geven van hoe elektronen zich binnen het atoom gedragen.
 In welke eenheden wordt de oplosbaarheid gemeten?
In welke eenheden wordt de oplosbaarheid gemeten?  Kwantificeren van veranderingen in oppervlaktechemie van houtachtige planten tijdens microbiële fermentatie
Kwantificeren van veranderingen in oppervlaktechemie van houtachtige planten tijdens microbiële fermentatie Wanneer deeltjes van een mengsel die niet aan elkaar zijn verbonden, hoe wordt dit dit genoemd?
Wanneer deeltjes van een mengsel die niet aan elkaar zijn verbonden, hoe wordt dit dit genoemd?  Wat is het kation van LiCl?
Wat is het kation van LiCl?  Wat zijn 2 kenmerken van een mengsel Wat is een voorbeeld?
Wat zijn 2 kenmerken van een mengsel Wat is een voorbeeld?
 Hoe quinoaplanten overtollig zout afwerpen en gedijen in zoute gronden
Hoe quinoaplanten overtollig zout afwerpen en gedijen in zoute gronden  Voedsel in de lucht? Het idee voor hoogbouwlandbouw wint terrein
Voedsel in de lucht? Het idee voor hoogbouwlandbouw wint terrein  Goedbedoelde klimaatmaatregelen kunnen het erger maken
Goedbedoelde klimaatmaatregelen kunnen het erger maken NYC om voorspeller in te huren, waarschuwingen opvoeren na overstromingen in Ida
NYC om voorspeller in te huren, waarschuwingen opvoeren na overstromingen in Ida Hoe leer je de wet van aantrekking?
Hoe leer je de wet van aantrekking?
Hoofdlijnen
- Wat gebeurt er als een enzym wordt renatureerd?
- Wat doet een biologische wetenschapstechnicus?
- De suiker-fosfaatruggen van de DNA Double Helix zijn in tegengestelde richtingen georiënteerd?
- Wat kan het effect zijn van het erven van meer dan normaal aantal chromosomen bij een mens?
- Wat is het aantal chromosomen in een edelsteen?
- Waarom is de zon zo helder?
- Hoe mechanische stimuli cellulaire signalering activeren
- Waarom zijn er 61 Anticodonen?
- Wat bepaalt de samenstelling van microben in de darmen van een grasmus?
- Voordelige gelfilm kan drinkwater uit woestijnlucht halen

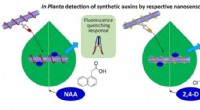
- Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
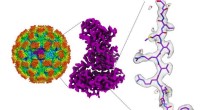
- Norovirusstructuren kunnen helpen bij het ontwikkelen van behandelingen voor voedselvergiftiging
- Nieuwe techniek kan medicijnontwerp stroomlijnen

- Destabilisatieprocessen in schuim

 Waar worden aderminerale afzettingen gevonden?
Waar worden aderminerale afzettingen gevonden?  Volgens nieuw onderzoek kunnen online fandom-gemeenschappen staatscensuur vergemakkelijken
Volgens nieuw onderzoek kunnen online fandom-gemeenschappen staatscensuur vergemakkelijken  Aanpassingen van Cheetahs om in een savanne te leven
Aanpassingen van Cheetahs om in een savanne te leven  Hoeveel mensen geloven eigenlijk in astrologie?
Hoeveel mensen geloven eigenlijk in astrologie?  Wat is het doel van fenolpthalein?
Wat is het doel van fenolpthalein?  Waarom zijn lava -stromen fijner korrelig dan opdringerige stollingsgesteenten?
Waarom zijn lava -stromen fijner korrelig dan opdringerige stollingsgesteenten?  We hebben een nieuwe strategie nodig om oudere volwassenen te beschermen tegen gewelddadige criminaliteit
We hebben een nieuwe strategie nodig om oudere volwassenen te beschermen tegen gewelddadige criminaliteit Zaadproductie en rekrutering van jonge bomen beïnvloeden de migratie als gevolg van de klimaatverandering
Zaadproductie en rekrutering van jonge bomen beïnvloeden de migratie als gevolg van de klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

