
Wetenschap
Hoe hebben subatomaire deeltjes en isotopen de atoomtheorie beïnvloed?
1. Ontdekking van subatomaire deeltjes:
* Dalton's atomaire theorie: De oorspronkelijke atoomtheorie voorgesteld door John Dalton (begin 1800) verklaarde dat atomen ondeelbaar waren en fundamentele deeltjes.
* Ontdekking van elektronen (J.J. Thomson, 1897): De ontdekking van elektronen bewees dat atomen niet ondeelbaar waren. Dit leidde tot de ontwikkeling van het "pruimpudding" -model, waarbij negatief geladen elektronen werden ingebed in een positief geladen bol.
* Discovery of the Nucleus (Ernest Rutherford, 1911): Rutherford's beroemde gouden folie -experiment toonde aan dat atomen een dichte, positief geladen kern in hun centrum hebben, met elektronen die eromheen draaien. Dit model, bekend als het nucleaire model, verving het "pruimpudding" -model.
* Discovery of Protons (Ernest Rutherford, 1919): Rutherford identificeerde protonen als positief geladen deeltjes in de kern.
* Discovery of Neutrons (James Chadwick, 1932): De ontdekking van neutronen, neutrale deeltjes in de kern, voltooide ons begrip van de basisbestanddelen van atomen.
2. Isotopen en atomaire massa:
* isotopen: De ontdekking van isotopen, atomen van hetzelfde element met verschillende aantallen neutronen, daagde het idee uit dat alle atomen van een element identiek waren. Dit leidde tot het begrip dat atomaire massa geen vaste waarde is, maar enigszins varieert vanwege de aanwezigheid van isotopen.
* massaspectrometrie: De ontwikkeling van massaspectrometrie stelde wetenschappers in staat om de precieze massa individuele atomen te meten en isotopen te identificeren.
* Herziene definitie van atomaire massa: De atomaire massa werd opnieuw gedefinieerd als het gewogen gemiddelde van de massa's van alle isotopen van een element, rekening houdend met hun relatieve overvloed.
evolutie van atomaire theorie:
De ontdekking van subatomaire deeltjes en isotopen leidde tot een fundamentele verschuiving in ons begrip van atomen:
* atomen zijn niet ondeelbaar: Ze hebben een interne structuur en zijn samengesteld uit kleinere deeltjes.
* Atomische massa is geen vaste waarde: Het weerspiegelt de gemiddelde massa van de isotopen van een element.
* Het atomaire model is constant verfijnd: De evolutie van de atomaire theorie gaat door met vooruitgang in ons begrip van de atomaire structuur, zoals de ontwikkeling van kwantummechanica en de ontdekking van subatomaire deeltjes voorbij protonen, neutronen en elektronen.
Samenvattend hebben subatomaire deeltjes en isotopen een revolutie teweeggebracht in de atomaire theorie, waaruit blijkt dat atomen niet fundamenteel zijn, maar een complexe interne structuur hebben, en dat atomaire massa geen vaste waarde is, maar een gewogen gemiddelde op basis van de aanwezigheid van isotopen. Deze ontdekkingen maakten de weg vrij voor ons huidige begrip van de atoomwereld en blijven verder onderzoek en verkenning inspireren.
 DNA-origami overtreft belangrijke drempels
DNA-origami overtreft belangrijke drempels Wat kan afleiden over de aantrekkingskracht tussen deeltjes in een stof met een laag smeltpunt?
Wat kan afleiden over de aantrekkingskracht tussen deeltjes in een stof met een laag smeltpunt?  Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten
Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten Slimme polymeren zetten elektrische energie om in mechanisch werk
Slimme polymeren zetten elektrische energie om in mechanisch werk Wat is het meest gebruikelijke gebruik voor cesium?
Wat is het meest gebruikelijke gebruik voor cesium?
 Op welke twee manieren kan de waarde van de bodem verlaagd worden?
Op welke twee manieren kan de waarde van de bodem verlaagd worden?  Patroonanalyses suggereren dat het mogelijk is om vanaf het begin de minimale aardbevingsgrootte te voorspellen
Patroonanalyses suggereren dat het mogelijk is om vanaf het begin de minimale aardbevingsgrootte te voorspellen Rotsvochtigheid in de Spaanse dehesas:een extra bron van water voor vegetatie
Rotsvochtigheid in de Spaanse dehesas:een extra bron van water voor vegetatie Waarom delen van de aarde in 3 miljard jaar nauwelijks zijn veranderd
Waarom delen van de aarde in 3 miljard jaar nauwelijks zijn veranderd Heeft menselijke geografie en fysiek zich te relateren?
Heeft menselijke geografie en fysiek zich te relateren?
Hoofdlijnen
- Waarom het zo moeilijk is om schepen bij te houden die niets goeds doen?
- Wat maakt een systeembenadering geldig voor wetenschappelijk onderzoek?
- Lijst met waterverontreinigende stoffen
- Waarom heeft het menselijk lichaam geen eiwitten opslag?
- Hoe creëren producenten hun eigen voedsel?
- Wat is de term die wordt gebruikt om de verspreiding van ongewenste microben te beschrijven?
- Is het waar, een manier om planten te classificeren is door hoe ze zich voortplanten?
- Waarom raken chromosomen meer gecondenseerd tijdens het representeren van cellen?
- Hoe weefselgeometrie de beweging van cellen door het lichaam beïnvloedt
- 3D-printen van zeer rekbare hydrogel met diverse UV-uithardbare polymeren
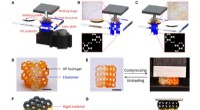
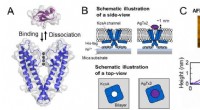
- Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
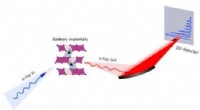
- De rol van de bovenbouw bij spanningsverlies in de eerste cyclus in lithium-ionbatterijen
- Moleculaire schalen op biologische membranen
- Nieuw algoritme zorgt voor snellere, diervrije chemische toxiciteitstesten

 Watchdog-groepen roepen op tot herziening van het Amerikaanse nucleaire lab-sham-proces
Watchdog-groepen roepen op tot herziening van het Amerikaanse nucleaire lab-sham-proces Hoe verhoogt onafhankelijke oriëntatie van chromosoom tijdens meiose de genetische variatie?
Hoe verhoogt onafhankelijke oriëntatie van chromosoom tijdens meiose de genetische variatie?  Hoe heeft thermische energie uw economie effect?
Hoe heeft thermische energie uw economie effect?  Simulaties tonen aan dat de uitlaatgassen van landers studies van maanijs kunnen vertroebelen
Simulaties tonen aan dat de uitlaatgassen van landers studies van maanijs kunnen vertroebelen Wat is de functie van een selectief permeabel celmembraan?
Wat is de functie van een selectief permeabel celmembraan?  De scheiding van allelen wordt genoemd?
De scheiding van allelen wordt genoemd?  Wat gebeurt er met de golfenergie als mediums vergelijkbaar zijn?
Wat gebeurt er met de golfenergie als mediums vergelijkbaar zijn?  Hoe verhoudt de Andromeda Galaxy zich met Melkweg?
Hoe verhoudt de Andromeda Galaxy zich met Melkweg?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

