
Wetenschap
Welke toestand van materie heeft de snelste moleculen?
Dit is waarom:
* gasmoleculen hebben de meeste kinetische energie. Kinetische energie is de energie van beweging. Gasmoleculen zijn vrij om te bewegen en met elkaar te botsen, wat resulteert in hoge gemiddelde snelheden.
* vloeistoffen hebben minder bewegingsvrijheid. Hoewel vloeibare moleculen voorbij elkaar kunnen bewegen, zijn ze nauwer verpakt dan gasmoleculen, wat leidt tot langzamere snelheden.
* vaste stoffen hebben de minste bewegingsvrijheid. Vaste moleculen worden gefixeerd in een rigide structuur, trillen op zijn plaats maar bewegen niet vrij.
Belangrijke opmerking: Zelfs binnen een bepaalde staat van materie varieert de snelheid van individuele moleculen. Temperatuur beïnvloedt direct de gemiddelde snelheid van moleculen. Hogere temperaturen betekenen sneller bewegende moleculen.
 Naarmate het klimaat warmer wordt, planten kunnen meer water nodig hebben, snijbenodigdheden voor mensen
Naarmate het klimaat warmer wordt, planten kunnen meer water nodig hebben, snijbenodigdheden voor mensen NASA-satelliet analyseert krachtige supertyfoon Mangkhut
NASA-satelliet analyseert krachtige supertyfoon Mangkhut Nieuw onderzoek toont hydrologische limieten aan bij het afvangen en opslaan van koolstof
Nieuw onderzoek toont hydrologische limieten aan bij het afvangen en opslaan van koolstof Controversiële testvlucht gericht op afkoeling planeet afgelast
Controversiële testvlucht gericht op afkoeling planeet afgelast Veerkracht van Yellowstones-bossen getest door ongekende brand
Veerkracht van Yellowstones-bossen getest door ongekende brand
Hoofdlijnen
- Eerste onderzoek dat aantoont dat vogels en niet alleen zoogdieren geeuwen kopiëren
- Wat is de 3 belangrijkste phyla van een schimmelachtige protist?
- Wat zijn de meest primitieve organismen die tegenwoordig een structuur hebben die te simpel is als cellen.?
- Meelkracht om voedselzekerheid te vergroten
- Zijn virussen op natuurlijke wijze ontstaan of zijn ze een hybride?
- Hoe het genoom is verpakt in chromosomen die tijdens de celdeling getrouw kunnen worden verplaatst
- Daling van huismus in verband met luchtvervuiling en slechte voeding
- Toont een dichotome sleutel evolutionaire relaties tussen organismen?
- Wat moet wetenschapper afleiden?
- Snuffelen welke plantaardige burgers het meest naar echt rundvlees ruiken

- Chemici maken thermohardend polymeer met behulp van amine en triketon dat recyclebaar is
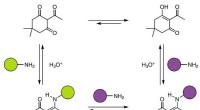
- Onderzoekers lossen 100 jaar oude metallurgiepuzzel op

- Nieuwe niet-destructieve optische techniek onthult de structuur van parelmoer

- Het aangaan van een 100 jaar oude uitdaging zou de weg kunnen banen naar digitale aroma's

 Welke krachten werken op een bal die in water zinkt?
Welke krachten werken op een bal die in water zinkt?  Waarom hebben Neptunus valleien?
Waarom hebben Neptunus valleien?  Wat gebeurt er als de zon de atmosfeer en het oppervlak van de aarde verwarmt?
Wat gebeurt er als de zon de atmosfeer en het oppervlak van de aarde verwarmt?  Wereldwijde stadsuitbreiding zorgt voor problemen
Wereldwijde stadsuitbreiding zorgt voor problemen Waarom nobele gassen zijn monoatomisch in het periodiek systeem?
Waarom nobele gassen zijn monoatomisch in het periodiek systeem?  De kleinste skeletten in de zeewereld waargenomen in 3D met synchrotron-technieken
De kleinste skeletten in de zeewereld waargenomen in 3D met synchrotron-technieken Hoe vaak ga je die loopband gebruiken?
Hoe vaak ga je die loopband gebruiken?  Waarom denk je dat metallic aanbetaling overvloedig overvloedig aanwezig is op plaatsen waar er loopgraven of vulkanen zijn?
Waarom denk je dat metallic aanbetaling overvloedig overvloedig aanwezig is op plaatsen waar er loopgraven of vulkanen zijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

