
Wetenschap
Waarom nobele gassen zijn monoatomisch in het periodiek systeem?
* Stabiele elektronenconfiguratie: Nobele gassen hebben een volledige buitenste schaal van elektronen, wat betekent dat ze het maximale aantal elektronen hebben dat hun buitenste energieniveau kan bevatten. Deze configuratie is ongelooflijk stabiel en niet -reactief.
* Minimale energie vereist: Om een chemische binding te vormen, moeten atomen elektronen winnen, verliezen of delen. Nobele gassen hebben al een stabiele configuratie, zodat ze geen interactie met andere atomen hoeven te communiceren om stabiliteit te krijgen. Dit maakt hen extreem niet -reactief en verklaart hun bestaan als afzonderlijke atomen.
* Zwakke interatomische krachten: De enige krachten die nobele gasatomen in elkaar houden, zijn zwakke van der Waals -krachten. Deze krachten zijn veel zwakker dan de chemische bindingen die atomen bij elkaar houden in moleculen.
Samenvattend: Nobele gassen zijn monoatomisch omdat hun stabiele elektronenconfiguratie hen ongelooflijk niet -reactief maakt en voorkomt dat ze bindingen vormen met andere atomen.
 Bewijsgestuurde manieren om gefocust te blijven wanneer je studeert
Bewijsgestuurde manieren om gefocust te blijven wanneer je studeert Wat zijn de verborgen voordelen van groene infrastructuur?
Wat zijn de verborgen voordelen van groene infrastructuur?  Model koppelt patronen in sediment aan regen, stijging en zeespiegelverandering
Model koppelt patronen in sediment aan regen, stijging en zeespiegelverandering Onderzoekers van CLOUD-experimenten laten zien dat emissies uit bossen de allereerste fase van wolkenvorming beïnvloeden
Onderzoekers van CLOUD-experimenten laten zien dat emissies uit bossen de allereerste fase van wolkenvorming beïnvloeden  Er zijn veranderingen nodig om de waterinfrastructuur in de VS te financieren
Er zijn veranderingen nodig om de waterinfrastructuur in de VS te financieren
Hoofdlijnen
- Wat is een bacterioscopist?
- Asymmetrieën van één cel bepalen hoe groepen cellen samen 3D-vormen vormen
- De chemische samenstelling van uitgeademde lucht uit menselijke longen
- Welke dieren vertoont geen segmentatie en menselijke wezens B-aardewormen C-insecten D-kwallen?
- Wat zijn dromen?
- Een bitter mysterie:wetenschappers sequencen 's werelds oudste plantengenoom van 6000 jaar oude watermeloenzaden
- Wiskundige modellen laten zien hoe organismen de som van hun genen overstijgen
- Waar komen de westerse honingbijen vandaan? Nieuw onderzoek vindt de goede plek
- Waar werken lipase op?
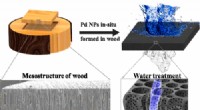
- Houtfilter verwijdert giftige kleurstof uit water
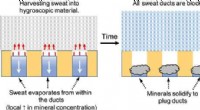
- Het zweet tegen zichzelf keren met een metaalvrije anti-transpirant
- Zelfreinigend beton kan gebouwen er als nieuw uit laten zien

- Nieuwe aanpak voor het opvangen van gas bevordert het beheer van nucleaire brandstof

- Natuurkundigen leggen uit hoe grote bolvormige virussen worden gevormd

 Welke organismen maken chitine?
Welke organismen maken chitine?  Project Air View brengt ultrafijne deeltjes in kaart, roet en andere stoffen in Amsterdamse lucht
Project Air View brengt ultrafijne deeltjes in kaart, roet en andere stoffen in Amsterdamse lucht Beweging van impuls van het ene knooppunt Ranvier naar het volgende wordt genoemd?
Beweging van impuls van het ene knooppunt Ranvier naar het volgende wordt genoemd?  Fracking kan sociale stress veroorzaken in nabijgelegen gebieden, volgens onderzoek
Fracking kan sociale stress veroorzaken in nabijgelegen gebieden, volgens onderzoek Een nieuwe fundamentele onderwaterkracht ontdekken
Een nieuwe fundamentele onderwaterkracht ontdekken Hoeveel bindingselektronen heeft zuurstof?
Hoeveel bindingselektronen heeft zuurstof?  Het korstmos dat zijn voortplantingsstrategie verandert afhankelijk van het klimaat
Het korstmos dat zijn voortplantingsstrategie verandert afhankelijk van het klimaat Speculatieve wormgat-echo's kunnen een revolutie teweegbrengen in de astrofysica
Speculatieve wormgat-echo's kunnen een revolutie teweegbrengen in de astrofysica
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

