
Wetenschap
Waarom aluminium goede dirigent?
1. Atomische structuur:
* valentie -elektronen: Aluminiumatomen hebben drie valentie -elektronen in hun buitenste schaal. Deze elektronen zijn losjes gebonden en kunnen gemakkelijk van atoom naar atoom gaan.
* Metallic binding: Aluminiumatomen worden bij elkaar gehouden door metalen bindingen. Dit type binding omvat een "zee" van gedelokaliseerde elektronen die vrij door de structuur van het metaal kunnen bewegen.
2. Elektronenmobiliteit:
* gratis elektronen: De losjes gebonden valentie -elektronen in aluminium zijn in wezen vrije elektronen. Ze kunnen vrij door de roosterstructuur van het metaal bewegen zonder sterk te zijn bevestigd aan een bepaald atoom.
* geleidbaarheid: Met deze mobiliteit van elektronen kunnen ze gemakkelijk elektrische ladingen dragen, waardoor aluminium een uitstekende geleider van elektriciteit is.
3. Warmtegeleiding:
* Elektronenbotsingen: Wanneer warmte wordt toegepast op aluminium, absorberen de vrije elektronen energie en bewegen ze sneller. Ze botsen met andere elektronen en atomen, waardoor energie over het materiaal wordt overgebracht. Dit proces maakt aluminium een goede warmtegeleider.
Samenvattend:
De combinatie van aluminium's losjes gebonden valentie -elektronen, metalen binding en de resulterende vrije elektronenbeweging geeft het een uitstekende geleidbaarheid voor zowel elektriciteit als warmte. Dit is de reden waarom aluminium wordt gebruikt in verschillende toepassingen zoals elektrische bedrading, kookgerei en koellichamen.
 Conspiracisme toont aan hoe belangrijk het is om te onderzoeken hoe bewijsmateriaal wordt gebruikt
Conspiracisme toont aan hoe belangrijk het is om te onderzoeken hoe bewijsmateriaal wordt gebruikt  NASA krijgt tropische storm Leslie bij de staart
NASA krijgt tropische storm Leslie bij de staart Hoe groepsjacht werkt in de open oceaan
Hoe groepsjacht werkt in de open oceaan  Opinie:waarom orkanen Harvey en Irma niet zullen leiden tot actie tegen klimaatverandering
Opinie:waarom orkanen Harvey en Irma niet zullen leiden tot actie tegen klimaatverandering Wat is een natuurlijke hete veer die af en toe waterstoom boven de grond spuit?
Wat is een natuurlijke hete veer die af en toe waterstoom boven de grond spuit?
Hoofdlijnen
- Kiemvrije diermodellen onthullen de rol van darmbacteriën in de gezondheid
- Wat is de unieke betekenis van letters a g t en c voor biologen?
- Wat zit er eigenlijk in vapes? We hebben ze uit elkaar gehaald om erachter te komen
- Wat is het orgaan van reproductie in zulke bloeiende planten als Crocus en Gladiolus?
- Hoe grassen inteelt vermijden
- Wat wordt kraakbeen geproduceerd door?
- Wat is positieve psychologie?
- Oude beenviskrachten heroverwegen hoe haaien evolueerden
- De locaties A P en E worden bezet door aminozuren die worden geassembleerd in een keten van polypeptide waar ze deel van uitmaken?
- Molecuul valt coronavirus op een nieuwe manier aan

- Video:Wat is leven? En zullen we het op andere planeten vinden?

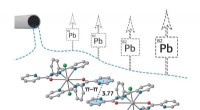
- Chemici stellen nieuwe reagentia voor voor de verwijdering van lood uit afvalwater
- Video:Veroorzaakt suiker diabetes?

- Een theoretische studie verklaart de natuurlijke selectie van eiwitten
 Wat kunnen oceanen vormen als de atmosfeer verandert?
Wat kunnen oceanen vormen als de atmosfeer verandert?  Hoe word je goed op Math
Hoe word je goed op Math Wat betekent de snelheid of traagheid van een geluid?
Wat betekent de snelheid of traagheid van een geluid?  Wat zijn eigenlijk essentiële diensten en wie beslist?
Wat zijn eigenlijk essentiële diensten en wie beslist? Hoe machines ons leren om innovatiever te zijn
Hoe machines ons leren om innovatiever te zijn SpaceX Starhopper beschadigd bij harde wind
SpaceX Starhopper beschadigd bij harde wind NASA vindt kortstondige Fausto snel vervaagd
NASA vindt kortstondige Fausto snel vervaagd Een methodologie voor het mogelijk maken van forensische analyse met behulp van hypervisor-kwetsbaarhedengegevens
Een methodologie voor het mogelijk maken van forensische analyse met behulp van hypervisor-kwetsbaarhedengegevens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

